

| 转化的氮气的物质的量 |
| 开始时氮气的物质的量 |
| 1.0mol/L |
| 5min |
| c2(NO) |
| c(N2)c(O2) |
| 1.02 |
| 0.8×1.0 |
| 转化的氮气的物质的量 |
| 开始时氮气的物质的量 |
| 0.5 |
| 1.3 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
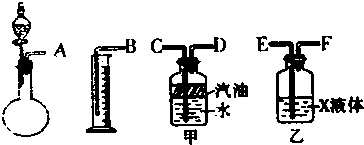
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
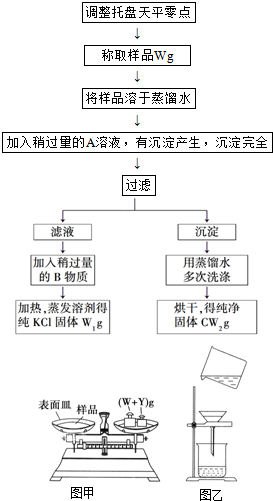 实验室里有一瓶KCl和CaCl2的固体混合物,通过下述实验方法可以确定该混合物中KCl和CaCl2的质量比,也可得到纯净的氯化钾.根据实验步骤填写下列空白.
实验室里有一瓶KCl和CaCl2的固体混合物,通过下述实验方法可以确定该混合物中KCl和CaCl2的质量比,也可得到纯净的氯化钾.根据实验步骤填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验目的 | 操作 | 实验现象 | 结论 |
| 1.检验Cl- | 取少许滤液于试管中, | 含有Cl- | |
| 2.检验NH4+ | 取少许滤液于试管中, | 含有NH4+ | |
| 3.检验Zn2+ | 取少许滤液于试管中,加入 稀氨水 | 先产生白色沉淀,继续加入氨水,沉淀又溶解 | 含有Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com