
����Ŀ����������������Դ�����ˮ�����Ⱦ�ǻ�����������Ҫ�о����⡣
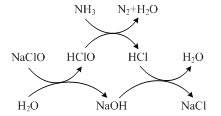
(1)��֪��Ӧ8NH3+6NO2=7N2+12H2O���������������ͻ�ԭ���������֮��Ϊ________��
(2)ˮ���й�������(��NH3��ʾ)�ᵼ��ˮ�帻Ӫ������
���ô������Ƴ�ȥ������ԭ������ͼ��ʾ��д����ͼʾ���ܷ�Ӧ��ѧ����ʽ��________��
�÷�Ӧ������¶ȣ��¶ȹ���ʱ����ȥ���ʽ��͵�ԭ����________��
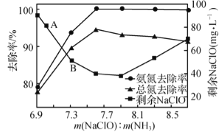
��ȡһ�����ĺ�������ˮ���ı�������������������Ӧһ��ʱ�����Һ�а���ȥ���ʡ��ܵ�(��Һ�����п����Եĺ����������е�Ԫ�ص�����)ȥ�����Լ�ʣ��������Ƶĺ�����m(NaCIO)m(NH3)�ı仯�����ͼ��ʾ����m( NaCIO)��m(NH3)>7.6ʱ��ˮ�����ܵ�ȥ���ʷ����½������ܵ�ԭ����________ ��
���𰸡�4��3 2NH3+ 3NaClO= N2+ 3NaCl+ 3H2O �¶ȹ��ߣ�HClO�����ֽ⣬����ȥ������֮���� �в���NH3��������NO2-��NO3-
��������
��1���÷�Ӧ��NH3��N�ɣ�3�۱�Ϊ0�ۣ����ϼ����ߣ������������ò���Ϊ�������NO2��N�ɣ�4�۱�Ϊ0�ۣ����ϼ۽��ͣ�����ԭ�����ò���Ϊ��ԭ��������������ͻ�ԭ��������ʵ���֮��Ϊ8:6=4:3��
��2���ٸ���ͼʾ�жϷ���������ԭ��Ӧ�ķ�Ӧ���������ݵ�ʧ�����غ��ԭ���غ���д��ѧ����ʽ���¶�Խ�ߣ���ѧ��Ӧ����Խ�죬�����¶ȹ��ߣ�HClO���ȶ��������ֽ⣻
�ڵ�m( NaCIO)��m(NH3)>7.6ʱ��NaCIO�������Խ��Ὣ��������ΪNO3-�ȸ�̬���ʡ�
(1)�÷�Ӧ��NH3��N�ɣ�3�۱�Ϊ0�ۣ����ϼ����ߣ�����������Ӧ������Ϊ�������NO2��N�ɣ�4�۱�Ϊ0�ۣ����ϼ۽��ͣ�������ԭ��Ӧ������Ϊ��ԭ��������������ͻ�ԭ��������ʵ���֮��Ϊ8:6=4:3��
(2)����ͼת�����̿�֪���÷�Ӧ�з�Ӧ��ΪNH3��NaClO��������ΪN2��NaCl2��H2O����˸÷�Ӧ�Ļ�ѧ����ʽΪ��2NH3��3NaClO=N2��3NaCl��3H2O��
���ڷ�Ӧ����������HClO��HClO���ȶ��������ֽ⣬����¶ȹ��ߣ�����ȥ���ʽ��ͣ�
��NaClO���������ԣ���������ʹ�ò���NH3��������NO2-��NO3- �� ʹ��ˮ�����ܵ�ȥ���ʽ��ͣ�


 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ա�����ȩΪԭ�ϣ�AlCl3 Ϊ�����Ʊ� 1��1�C�������飬�䷴Ӧԭ��Ϊ��

��֪��AlCl3 ������ˮ�ᷢ����ǿ��ˮ�⡣ I����ȡװ����ͼ��ʾ��

��1���÷�Ӧ����Ʒ�Ӧ�¶�Ϊ 20�档���� 20��ķ�����________ ���÷�Ӧ������ 20�� �Ŀ���ԭ���ǣ�_______ ��
��2������ a �������� __________ ������ _________ ��װ�� c ���������� �� HCl��д������ HCl �Ļ�ѧ����ʽ ________��װ�� b �������� _____________ ��
��ʵ�������������ƿ�еĻ���ﵹ����ϡ�����У��÷�Һ©��������л��㣬�� ����ˮ��2��̼������Һ��ˮϴ�ӣ�ϴ�Ӻ����������ˮ����þ���壬���ˡ����õ� 1�� 1�C�������顣
��3����Һ©���У���Ʒ��____���������������������㣻ϴ�Ӳ����У��ڶ���ˮϴ��Ŀ�� ��____����ˮ����þҲ�������� ______________ ���档
��4�������ᴿʱ������װ���лᵼ���ռ����IJ�Ʒ�л��еͷе����ʵ�װ����______ ��ѡ���ţ���
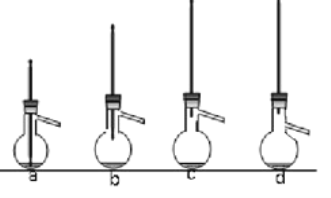
��5��������ƿ�м��� 120mL �����ܶ� 0��88g/mL����19g A1C13 �� 3��7g ��ȩ��20��ʱ��ַ�Ӧ�� �Ƶô����� 1��1�C�������� 7��8g����ʵ��IJ���ԼΪ ___________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������зḻ����Դ����ͼΪ��ˮ��Դ���õIJ��ֹ��̡�

�����й�˵����ȷ���ǣ� ��
A.�ó���ʯ��ˮ�ɼ���NaHCO3��Na2CO3
B.�ڢ۲��͵ڢݲ���������������ԭ��Ӧ
C.�ڵڢۢܢݲ�����Ԫ�ؾ�������
D.��ҵ��ͨ����ⱥ��MgCl2��Һ��ȡ����þ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��dz����¼��ֳ�������ĵ���ƽ�ⳣ����
���� | ���뷽��ʽ | ����ƽ�ⳣ��K |
CH3COOH | CH3COOH | K=1.6��10-5 |
H2C2O4 | H2C2O4 HC2O4- | K1=5.9��10-2 K2=6.4��10-5 |
H2CO3 | H2CO3 HCO3- | K1=4.4��10-7 K2=5.6��10-11 |
H2S | H2S HS- | K1=9.1��10-8 K2=1.1��10-15 |
�ش��������⣺
(1)ij�¶��£���ˮ�е�c(H+)=2.0��10-7mol��L-1�����¶Ȳ��䣬����ϡ����ʹc(H+)=5.0��10-6mol/L������ˮ�������c(H+)Ϊ___mol��L-1��
(2)�����������ӽ��H+������ǿ����___��
A.HCO3- B.C2O42- C.S2- D.CH3COO-
(3)������1.0mol��L-1��CH3COOH��Һ�е�c(H+)=___mol��L-1��
(4)�����£���ˮϡ��0.1mol��L-1��H2C2O4��Һ������˵����ȷ����___��
A.��Һ��n(H��)��n(OH-)���ֲ���
B.��Һ��ˮ�����c(H��)��c(OH-)���ֲ���
C.��Һ��![]() ���ֲ���
���ֲ���
D.��Һ��c(OH-)����
(5)��CH3COOH��Һ��������Na2CO3��Һ�У���Ӧ�����ӷ���ʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��2A(s) ![]() B(g)+C(g)����һ�������µĸ����ܱ������У���ʼʱ����һ������A�����жϷ�Ӧ�ﵽƽ��״̬����( )
B(g)+C(g)����һ�������µĸ����ܱ������У���ʼʱ����һ������A�����жϷ�Ӧ�ﵽƽ��״̬����( )
�ٵ�λʱ��������2molA��ͬʱ����1molB ��v (B): v (C)=1:1 ���ܱ������л�������ƽ��Ħ���������� �ܻ��������ܶȲ��ٸı� ��B������������ٸı� ��������ѹǿ���ٸı�
A. 3�� B. 4�� C. 5�� D. 6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������̼�ܵ����Ƴɹ������˿Ƽ��Ľ������õ绡���ϳɵ�̼���ܳ����д�������������̼������������̼���������������������ᴿ���䷴Ӧ�еķ�Ӧ�����������C��CO2��H2SO4��K2Cr2O7��K2SO4��Cr2(SO4)3��H2O���֡�
(1)���������������(������ƽ)��C+________+H2SO4����________+______+Cr2(SO4)3+H2O��
(2)������Ӧ����������(�ѧʽ)________����������Ԫ����(��Ԫ�ط���)________��
(3)H2SO4��������Ӧ�б��ֳ�����������(��ѡ�����)________��
A�������� B�������Ժ����� C������ D����ԭ�Ժ�����
(4)����Ӧ�е���ת����0.8 mol��������������ڱ�״���µ����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��Ӧ�У���Ӧ�����A��B��C�����ʵ���Ũ��(c)��ʱ��(t)��ϵ���±���ʾ��
��ʼ | 2 min | 4 min | 6 min | |
c (A)(mol/L) | 1.45 | 1.28 | 1.00 | 1.00 |
c (B)(mol/L) | 0.38 | 0.72 | 1.28 | 1.28 |
c (C)(mol/L) | 0.095 | 0.18 | 0.32 | 0.32 |
����˵����ȷ���ǣ� ��
A.�÷�Ӧ�Ļ�ѧ����ʽΪA = 2B+C
B.4 minĩA��ת����ԼΪ31%
C.4~6minʱ����Ӧֹͣ��
D.����Ӧ�����ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨij̼������Ʒ�Ĵ��ȣ�ȡһ������̼������ƷͶ�뵽40mLδ֪Ũ�ȵ������У�����ǡ����ȫ��Ӧ(���ʲ���Ӧ)�����ɶ�����̼����224mL����״���£������㣺
(1)��̼������Ʒ��̼���Ƶ����ʵ�����_____________��
(2)��������ʵ���Ũ����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Һ�ĵ絼��Խ��������Խǿ����0.100 mol��L��1��NaOH��Һ�ζ�10.00 mLŨ�Ⱦ�Ϊ0.100 mol��L��1 �������CH3COOH��Һ�����ô�������õζ���������Һ�ĵ絼����ͼ��ʾ������˵����ȷ����
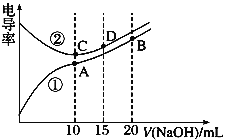
A. ���ߢڴ����ζ�CH3COOH��Һ������
B. A����Һ�У�c(CH3COO��)��c(OH��)��c(H��)��0.1 mol��L��1
C. ����ͬ�¶��£�A��B��C������Һ��ˮ�ĵ���̶ȣ� A��C��B
D. D����Һ�У�c(Cl��)+ 2c(H��)��2c(OH��)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com