
| A. | 原子半径:r(N)>r(M)>r(Y)>r(X) | |
| B. | X与Y形成的化合物溶于水,溶液显碱性 | |
| C. | 简单气态氢化物的热稳定性:M>N>X | |
| D. | 单质的熔点:Y>N>M>X |
分析 M原子的最外层电子数是内层电子数的一半,应为P元素,X与M同主族,则X为N元素,N的单质是一种有色气体,可用于自来水的消毒,则N为Cl元素,四种元素原子最外层电子数之和为19,则Y的最外层电子数为19-5-5-7=2,则Y为Mg元素,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:由以上分析可知X为N元素,Y为Mg元素、M为P元素、N为Cl元素.
A.同周期元素从左到右原子半径逐渐减小,应为r(Y)>r(M)>r(N)>r(X),故A错误;
B.X与Y形成的化合物为Mg3N2,可与水反应生成氨气,溶液呈碱性,故B正确;
C.非金属性Cl>N>P,元素的非金属性越强,对应的氢化物越稳定,故C错误;
D.P常温下为固体,氯气为气体,则单质的熔点P>Cl2,故D错误.
故选B.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析判断能力,明确原子结构、物质性质及结构是解本题关键,易错选项是D,注意物质熔沸点与晶体类型有关,分子晶体熔沸点与分子间作用力和氢键有关,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 合成纤维、光导纤维都属于有机高分子材料 | |
| B. | 氟利昂作制冷剂会加剧雾霾天气的形成 | |
| C. | 天津港爆炸案对剧毒的氰化钠(NaCN)喷洒双氧水消毒,是利用了双氧水的氧化性 | |
| D. | 利用加热的方法杀死人体内感染的埃博拉病毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
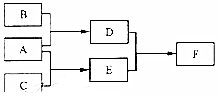 X、Y、Z为原子序数依次增大的短周期主族元素,三种元素属于不同周期,下列转化关系中,A、B、C是X、Y、Z对应的三种气态单质,其余均为常见化合物,下列分析正确的是( )
X、Y、Z为原子序数依次增大的短周期主族元素,三种元素属于不同周期,下列转化关系中,A、B、C是X、Y、Z对应的三种气态单质,其余均为常见化合物,下列分析正确的是( )| A. | 离子半径:Y>Z | B. | Z的含氧酸均为强酸 | ||
| C. | 与Y同周期氰化物中D最稳定 | D. | F含离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
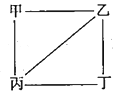 X、Y、Z、W为原子序数递增的4种短周周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如下图所示反应关系(图中“一”相连的两种物质能发生反应).下列判断正确的是( )
X、Y、Z、W为原子序数递增的4种短周周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如下图所示反应关系(图中“一”相连的两种物质能发生反应).下列判断正确的是( )| A. | X是元素周期表中非金属性最强的元素 | |
| B. | Z位于元素周期表第3周期IA族 | |
| C. | 4种原子中,Y原子半径最小 | |
| D. | W的阴离子可能促进水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
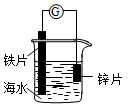
| A. | 锌片发生氧化反应作阴极 | |
| B. | 电子从铁片经过导线流向锌片 | |
| C. | 铁片上电极反应为:O2+2H2O+4e→4OH- | |
| D. | 该装置可用于研究外加电流阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
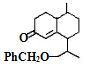
| A. | 属于芳香烃 | B. | 是高分子化合物 | ||
| C. | 可使溴水和酸性高锰酸钾溶液褪色 | D. | 苯环上的一氯取代物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 MnSO4在工业中有重要应用.用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:
MnSO4在工业中有重要应用.用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:| 离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
| 开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
| 完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com