
【题目】下列离子方程式中,不正确的是
A. 二氧化锰与浓盐酸加热反应:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 氯化镁溶液与氨水反应:Mg2++2NH3·H2O=Mg(OH)2↓+2NH
C. 金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D. 氯化铁溶液与碘化钾溶液反应:Fe3++2I-=Fe2++I2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3·5H2O) 俗名“大苏打”。易溶于水,难溶于乙醇,沸点为100℃,酸性或加热条件下易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
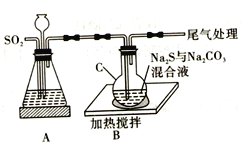
回答下列问题:
(1)装置A可用于观察SO2的生成速率,其中的液体最好选择_____________(填序号)。若装置堵塞使气流不畅,则A中的现象为_______________________________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
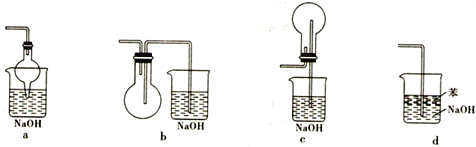
(2)尾气处理可以选择以下装置中的________(填序号)。
(3)反应过程中若pH值小于7则会降低产率,请用离子方程式解释原因:_________________________。
(4)请写出装置C中发生反应的化学方程式:_________________________。
(5)反应结束后,取C中混合物趁热过滤,取滤液于蒸发皿中, ______________,抽滤,洗涤,低温下干燥得产品。洗涤时要尽量减少产品的损失,其具体操作是_________________________。
(6)为检验制得的产品的纯度,该实验小组称取4g 的产品配制成250mL 硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入20mL 0.0lmol·L-1KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配的Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+ S4O62-,实验数据如下表:
实验序号 | 1 | 2 | 3 |
Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.2 |
当滴入最后一滴Na2S2O3溶液时,溶液___________,且半分钟内不变化,则达到终点。计算该产品的纯度是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾和浓盐酸可以发生下列反应:2KMnO4+16HCl(浓)===5Cl2↑+2MnCl2+2KCl+8H2O
(1)用双线桥法表示此反应的电子转移的方向及数目_____________
(2)该反应的氧化剂是______,还原剂是________。HCl表现 ___________性和 ____性。
(3)若消耗0.2 mol氧化剂,转移电子的物质的量是________ mol。生成氯气在标准状况下的体积是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国北方的山岗荒坡间有一种草本植物,别名奈何草,其中含有抗菌作用的某有机物M的合成路线如下图所示:
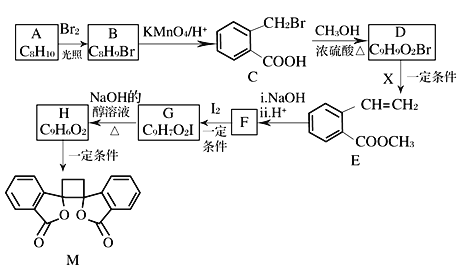
已知:ⅰ.RCH2Br![]() R—HC=CH—R'
R—HC=CH—R'
ⅱ.R—HC=CH—R' ![]()
![]()
ⅲ.R—HC=CH—R' ![]()
![]() (以上R、R'、R″代表氢、烷基或芳基等)
(以上R、R'、R″代表氢、烷基或芳基等)
(1)A的化学名称为_____,B的核磁共振氢谱显示为_____组峰。
(2)由C生成D的反应类型为_____。
(3)1 mol M与足量NaOH溶液反应,消耗_____mol NaOH。
(4)X的结构式为_____,F的结构简式为_____________。
(5)由G生成H的化学方程式为_______________________________。
(6)符合下列条件的E的同分异构体共_____种(不考虑立体异构)。
①芳香族化合物 ②与E具有相同官能团 ③能发生银镜反应 ④酸性条件下水解产物遇氯化铁溶液显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现:工业革命前的65万年间,地球大气层中的温室气体稳定,CO2含量一直处在180 ppm~289 ppm之间,CH4含量在320 ppb~720 ppb之间,现在大气中的CO2和CH4含量分别高达380 ppm和1700 ppb,导致温室气体含量变化的主要原因是( )
①以煤为能源的机器的广泛使用 ②以石油为能源的机器的广泛使用
③以原子能为能源的核工业的发展 ④以风能、太阳能为能源的新工业的发展
A. ①② B. ①③ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的脱氧剂,其制备方法是向Na2CO3溶液中通入SO2,生成NaHSO3和CO2,一定条件下NaHSO3转化为Na2S2O5。
完成下列填空:
(1)碳原子的原子结构示意图是____________。氧原子核外能量不同的电子有_____种。CO2的电子式是_________________。
(2)从原子结构的角度,解释氧元素的非金属性比硫元素强的原因。______________________
(3)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其化学方程式为_______________。
证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________。
(4)Na2S2O5作脱氧剂时的反应原理为Na2S2O5+O2+H2O→Na2SO4+H2SO4,该反应中,氧化产物是_____;若反应中转移了0.04 mol的电子,有____g Na2S2O5参加反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+……,然后测定其质荷比。某有机物样品的质荷比如下图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )


A. 甲醇 B. 丙烷 C. 甲烷 D. 乙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com