
| A、某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | ||
| B、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的102倍 | ||
| C、常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42- | ||
D、常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中
|
| c(OH-) |
| c(H+) |
| c(OH-) |
| c(H+) |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁溶于稀硝酸,溶液变为浅绿色:Fe+4H++NO3-═Fe3++NO↑十2H2O |
| B、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
C、向水杨酸(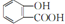 )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: |
| D、0.01mol?L-1 NH4Al(SO4)2溶液与0.02mol?L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COO-+H2O?CH3COOH+OH- |
| B、NH4++H2O═NH4OH+H+ |
| C、CH3COOH+NaOH═CH3COONa+H2O |
| D、NaCl+H2O═NaOH+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )| A、R和Z形成的化合物属于共价化合物 |
| B、Y单质能在X的单质中燃烧,生成淡黄色物质Y2X2 |
| C、X、Z形成的化合物化学式为Z2X3,它属碱性氧化物 |
| D、在常温下,Z单质能溶于W的最高价氧化物对应水化物浓溶液中,生成氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铵固体与消石灰反应制备氨气:NH4++OH-=NH3↑+H2O | ||||
B、用石墨棒作电极电解饱和食盐水:Cl-+Na+
| ||||
| C、硫酸铝溶液与过量氨水反应的离子方程式:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ | ||||
| D、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某混合溶液中可能大量含有的离子如下表所示:
某混合溶液中可能大量含有的离子如下表所示:| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | Cl-、Br-、OH-、CO32-、AlO2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com