
分析 K2CO3水解而使溶液呈碱性,滴入酚酞,溶液变红;再滴入过量的BaCl2溶液,碳酸根离子和钡离子反应生成碳酸钡沉淀,由于CO32-浓度减小,水解平衡左移,OH-浓度减小,溶液褪色,据此即可解答.
解答 解:K2CO3溶液中的CO32-易水解生成氢氧根离子:CO32-+H2O?HCO3-+OH-,导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,滴入酚酞,溶液变红;
向溶液中加入氯化钡后,钡离子和碳酸根离子反应生成碳酸钡沉淀,Ba2++CO32-═BaCO3↓(白色).由于CO32-浓度减小,水解平衡左移,OH-浓度减小,溶液中只有NaCl和BaCl2,呈中性,溶液褪色,
故答案为:产生白色沉淀,溶液由红色变为无色;CO32-水解呈碱性使酚酞变红:CO32-+H2O?HCO3-+OH-,加入BaCl2后,CO32-转化为BaCO3沉淀,水解平衡左移,OH-浓度减小,溶液中只有NaCl和BaCl2,呈中性,溶液褪色.
点评 本题考查了盐的水解原理及其应用,题目难度不大,明确碳酸根离子的水解及其影响因素是解答本题的关键,试题培养了学生的分析能力及灵活应用能力.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:选择题
| 分类 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 盐酸 | NaCl溶液 | 硫酸 | 干冰 |
| B | 胆矾 | Fe(OH)3胶体 | 硫酸钡 | 乙醇 |
| C | 石墨 | 空气 | 苛性钾 | 碳酸钙 |
| D | 浓硫酸 | 氨水 | 氯化钠 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
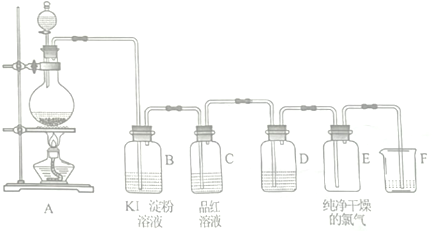
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2和 | B. | CH2═CH-CH2-CH3和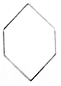 | ||
| C. | CH≡C-CH2-CH3和CH2═CH-CH═CH2 | D. | 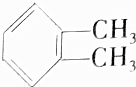 和 和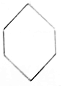 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
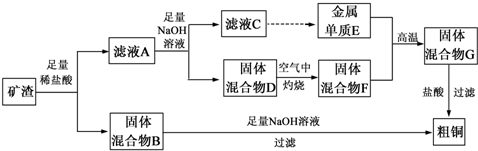
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com