
科目:高中化学 来源: 题型:阅读理解
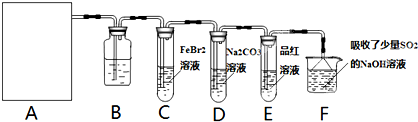
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
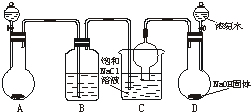 侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为:
侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为:查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省东山县第二中学高一第一次月考化学试卷(带解析) 题型:实验题
(12分)今年5月我区举行实验技能考查,某兴趣小组的同学在帮助老师准备化学实验时,发现实验台上整齐摆放的药品中(见下图),有一试剂瓶的标签破损。为了鉴定该试剂成分,同学们做了以下探究:
【提出问题】这瓶试剂的成分是什么?
[讨论]根据受损标签及实验室药品分类摆放的原则,这瓶试剂可能不是_______________________;
A.酸 B.碱 C.盐
[猜想]①可能是NaOH溶液;②可能是Na2CO3溶液;
③可能是_______________________(写一种)。
[探究活动]
(1)小军取少量试样于小试管中,滴加酚酞试液,溶液变为红色。由此小军认为猜想①正确。
经同学们交流讨论后,一致认为小军的方案不可行,理由是_______________________
(2)小华同学认为,虽然小军的实验不能得到正确的结论,但只要再往溶液中滴加一种氯化
物溶液,同样能得出正确的结论。
| 操作步骤 | 实验现象 | 实验结论 |
| 取少量滴有酚酞试液的试样于小试管中,滴加足量的___________ | 溶液由红色褪为无色 且有白色沉淀产生 | 猜想②正确 |
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取少量试样于小试管中,滴加适量的_______________________ | _________________ _________________ | 猜想②正确 有关化学方程式 _________________ |
查看答案和解析>>
科目:高中化学 来源:2015届福建省高一第一次月考化学试卷(解析版) 题型:实验题
(12分)今年5月我区举行实验技能考查,某兴趣小组的同学在帮助老师准备化学实验时,发现实验台上整齐摆放的药品中(见下图),有一试剂瓶的标签破损。为了鉴定该试剂成分,同学们做了以下探究:
【提出问题】这瓶试剂的成分是什么?

[讨论]根据受损标签及实验室药品分类摆放的原则,这瓶试剂可能不是_______________________;
A.酸 B.碱 C.盐
[猜想]①可能是NaOH溶液;②可能是Na2CO3溶液;
③可能是_______________________(写一种)。
[探究活动]
(1)小军取少量试样于小试管中,滴加酚酞试液,溶液变为红色。由此小军认为猜想①正确。
经同学们交流讨论后,一致认为小军的方案不可行,理由是_______________________
(2)小华同学认为,虽然小军的实验不能得到正确的结论,但只要再往溶液中滴加一种氯化
物溶液,同样能得出正确的结论。
|
操作步骤 |
实验现象 |
实验结论 |
|
取少量滴有酚酞试液的试样于小试管中,滴加足量的___________ |
溶液由红色褪为无色 且有白色沉淀产生 |
猜想②正确 |
(3)小亮发现要进一步确定(1)中的成分,只需选择上图已有的试剂就能把它鉴定出来。于是他们进行了如下实验。
|
操作步骤 |
实验现象 |
结论及化学方程式 |
|
取少量试样于小试管中,滴加适量的_______________________ |
_________________ _________________ |
猜想②正确 有关化学方程式 _________________ |
[实验反思]实验室盛放NaOH溶液的试剂瓶不能用玻璃塞,其原因是:NaOH与玻璃中的
SiO2发生反应,其化学方程式为2NaOH + SiO2= X + H2O,产物X使瓶口与塞子粘合在一起。
试推测X的化学式为_________________。
查看答案和解析>>
科目:高中化学 来源:期末题 题型:填空题
填空回答:
(1)在实验室里,当向一种未知试液里加入足量___________,此时无沉淀出现,再加入__________,如果有白色沉淀出现,则可以确证原试液中有存在SO42-。该实验中肯定发生的反应的离子方程式为
______________________。
(2)盛放烧碱溶液的玻璃试剂瓶不能用玻璃塞,是为了防止发生___________________________反应(用化学方程式表示),而使瓶塞与瓶口粘在一起。
(3)在40mL0.10mol/LBaCl2溶液中,加入VmL 0.10mol/L H2SO4溶液(过量),使沉淀完全。将反应后的混合物过滤,取滤液的一半,在滤液中加入25mL 0.20mol/L NaOH溶液,恰好至呈中性。则V=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com