
【题目】1mol有机物X最多能与1 mol HCl发生加成反应得到Y,1 mol Y能与4 mol Cl2在一定条件下发生取代反应得到Z。已知Y分子中的碳碳键都是单键,Z分子中没有氢原子,则X的结构简式可能是( )
A.![]() B.CH≡CH
B.CH≡CH
C.![]() D.CH≡CCH3
D.CH≡CCH3
【答案】A
【解析】
1mol有机物X最多能与1molHCl发生加成反应得到Y,则X中含1mol碳碳双键,且1mol Y能与4mol Cl2在一定条件下发生取代反应得到Z,已知Y分子中的碳碳键都是单键,Z分子中没有氢原子,则Y最多发生四氯取代,与HCl加成引入1个H,则X中只有3个H,以此来解答。
由上述分析可知,1molX中含1mol双键、3mol氢原子,
A.1molCH2=CHCl含1mol双键,3mol氢原子,故A符合题意;
B.CH≡CH含三键,与HCl以1:2加成,故B不符合题意;
C.1molCH2=CH2中含4mol氢原子,故C不符合题意;
D.丙炔含三键、且1mol分子中含4mol氢原子,故D不符合题意;
答案选A。


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+等)为原料制备氧化锌的流程如下:
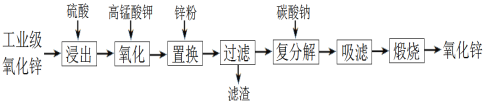
其中“氧化”加入KMnO4是为了除去浸出液中的Fe2+和Mn2+。下列有关说法错误的是
A. 浸出时通过粉碎氧化锌提高了浸出率
B. “氧化”生成的固体是MnO2和Fe(OH)3
C. “置换”加入锌粉是为了除去溶液中的Cu2+、Ni2+等
D. “煅烧”操作用到的仪器:玻璃棒、蒸发皿、泥三角
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由化合物A制备可降解环保塑料PHB和一种医药合成中间体J的合成路线如图:
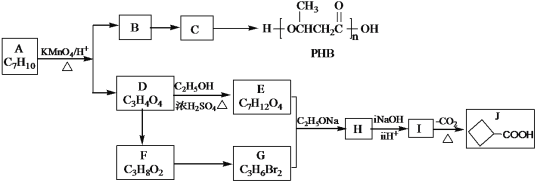
已知:
ⅰ.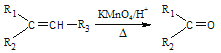 +R3—COOH(—R1、—R2、—R3均为烃基)
+R3—COOH(—R1、—R2、—R3均为烃基)
ⅱ.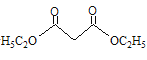 +2RBr
+2RBr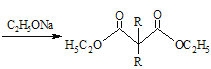 +2HBr
+2HBr
回答下列问题:
(1)C→PHB的反应类型是__________________。
(2)B中官能团的名称是__________________。
(3)A的结构简式是__________________。
(4)D→E的反应方程式是_____________________________。
(5)E+G→H的反应方程式是____________________________。
(6)X是J的同分异构体,满足下列条件的有_种(不考虑顺反异构)。
①链状结构;
②既能发生银镜反应,又能发生水解反应。
其中核磁共振氢谱有三组峰,且峰面积之比为6:1:1的结构简式是_________。
(7)已知:2CH3CHO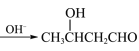 。
。
以乙烯为起始原料,选用必要的无机试剂合成C,写出合成路线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中充有2molSO2和一定量的O2,发生反应2SO2(g)+O2(g)![]() 2SO3(g)。当反应进行到4min时,测得此时SO2为0.4mol,则2min时密闭容器中SO3的物质的量为( )
2SO3(g)。当反应进行到4min时,测得此时SO2为0.4mol,则2min时密闭容器中SO3的物质的量为( )
A.1.6molB.1.2molC.大于1.6molD.小于1.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态_________(填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为____,其中Fe的配位数为_____________。
(3) NH4H2PO4中P的_______杂化轨道与O的2p轨道形成 σ 键。
(4)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
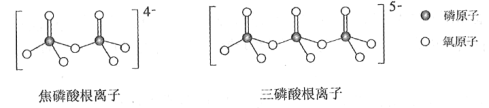
这类磷酸根离子的化学式可用通式表示为____________(用n代表P原子数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1:1。请回答:
(1)组成A分子的原子的核外电子排布式是________________;
(2)B的分子式分别是 ___________;C分子的立体结构呈_________ 形,该分子属于_____________分子(填“极性”或“非极性”);
(3)向D的稀溶液中加入少量氯化铁溶液,反应的化学方程式为_____________________________
(4) 若将1molE在氧气中完全燃烧,只生成1molCO2和2molH2O,则E的分子式是 __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,⑦(NH4)2SO4,⑧乙醇中,由极性键形成的非极性分子有_______(填序号,以下同),含有金属离子的物质是__,分子间可形成氢键的物质是________,属于离子晶体的是__,属于原子晶体的是__,①~⑤五种物质的熔点由高到低的顺序是__。
(2)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500 ℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__。
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.__;B.__;C.__D.____。
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为有机物,其中A是化学实验中常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图甲所示:
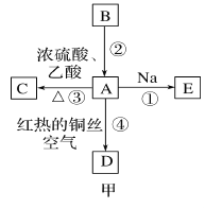
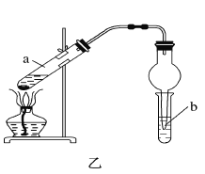
(1)写出B的结构简式________;A中官能团的名称为________。
(2)验证有机物乙酸中含有![]() 所用的试剂是_______,实验现象是_______。
所用的试剂是_______,实验现象是_______。
(3)写出下列反应的化学方程式:
反应①______________;
反应④______________。
(4)实验室利用反应③制取C,常用上图乙装置:
①a试管中主要反应的化学方程式为_________。反应类型是________。
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是__________。
③试管b中观察到的现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,体积均为25.00mL,浓度均为0.0100mo1L-1的HA、H3B溶液分别用0.0100mo1L-1NaOH溶液滴定,溶液的pH随V(NaOH)变化曲线如图所示,下列说法正确的是( )
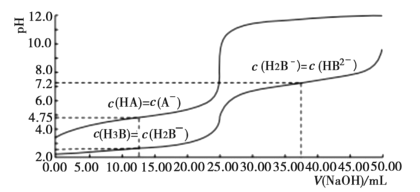
A.25℃时,0.0100mo1L-1Na2HB溶液的pH>7
B.向HA溶液中滴加NaOH溶液至中性,c(A-)<c(HA)
C.NaOH溶液滴定HA溶液应选甲基橙作指示剂
D.25℃时,H2B-离子的水解常数的数量级为10-3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com