
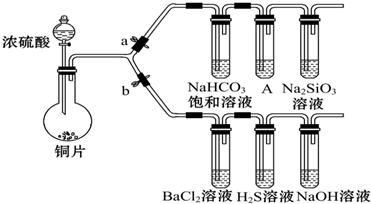
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
分析 (1)①若大量的SO2通入NaOH溶液中,生成NaHSO3;
②二氧化硫中硫元素的化合价是+4价,被硫化氢中-2价的硫还原;
③氯气具有氧化性,能将二氧化硫氧化成+6价的硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀;
(2)①铜与浓硫酸反应,铜被氧化成+2价的铜离子,硫酸被还原成+4价的二氧化硫;高锰酸钾有强氧化性,能氧化二氧化硫;
②验证碳、硅非金属性的相对强弱,是通过碳酸和可溶性硅酸盐反应析出硅酸沉淀实现的,所以为了保证实验效果和实验的顺利进行,须检查装置的气密性;
③当A中KMnO4溶液没有完全褪色,说明二氧化硫已经完全除尽,盛有Na2SiO3溶液的试管中出现白色沉淀,说明碳的非金属性比硅强;
解答 解:(1)①若大量的SO2通入NaOH溶液中,生成NaHSO3,方程式为SO2+NaOH═NaHSO3,故答案为:SO2+NaOH═NaHSO3;
②二氧化硫中硫元素的化合价是+4价,有氧化性,二氧化硫气体与H2S溶液常温下反应,生成黄色固体硫(单质)和水,反应的方程式为2H2S+SO2═3S↓+2H2O,
故答案为:2H2S+SO2═3S↓+2H2O;
③BaCl2溶液中无明显现象,将其分成两份,一份滴加氯水溶液,氯水中有氯气分子,氯气分子具有氧化性,能把二氧化硫氧化成+6价的硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀,反应的方程式为Ba2++SO2+Cl2+2H2O═BaSO4↓+4H++2Cl-,另一份中滴加氨水,二氧化硫和水生成亚硫酸,亚硫酸和氨水反应生成亚硫酸铵,亚硫酸铵电离出氨根离子和亚硫酸根离子,亚硫酸根离子和钡离子反应生成亚硫酸钡沉淀,
故答案为:
| BaSO4 | BaSO3 |
点评 本题考查实验方案的设计,涉及化学用语、物质性质、对装置的理解等,为高频考点,侧重于学生的分析能力和实验能力,题目难度中等,理解实验原理是解题的关键,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 2H++2e→H2↑ | B. | 2H20+2C1-→H2↑+C12↑+20H- | ||
| C. | 2Cl--2e→Cl2↑ | D. | 2H20+2NaCl→H2↑+Cl2↑+2Na0H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制乙酸乙酯时,不断的蒸出乙酸乙酯来提高产率 | |
| B. | CO有毒,会与血液中血红蛋白(用Hb表示)化合发生下述反应:CO+HbO2?HbCO+O2,输氧抢救CO中毒的患者 | |
| C. | 皂化反应采用强碱性条件,促使油脂水解 | |
| D. | 合成氨时,采用高温与高压来提高氨气的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HI体积分数 | 1min | 2min | 3min | 4min | 5min | 6min | 7min |
| 条件I | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
| 条件II | 20% | 33% | 43% | 52% | 57% | 65% | 65% |
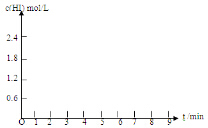
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
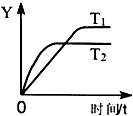
| A. | 温度T2<T1 | |
| B. | 反应达到平衡后放出99kJ的热量 | |
| C. | Y可能是SO2的转化率或SO3的浓度 | |
| D. | 反应达到平衡后容器内气体的密度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成化学式为Z2T的离子化合物.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成化学式为Z2T的离子化合物.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 最高价氧化物对应的水化物的酸性:T<R | |
| C. | 气态氢化物的稳定性:Y>T | |
| D. | 由X、Y、Z、T四种元素组成的化合物水溶液一定呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com