
【题目】洗涤盛有植物油的试管,宜选用的试剂是( )
A. 稀硫酸 B. 热水 C. 热碱液 D. 稀硝酸
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下图所示(部分反应条件及产物略去):
![]()
(1)若A是一种金属,C是淡黄色固体,则B的化学式为______,A→C反应的化学方程式为_________。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为_______,B→C反应的化学方程式为___。
A和C是否可以发生反应______(填“能”或“不能”),若能,反应的化学方程式为____________(若不能,此空不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活生产中常见的物质里含有的有机物属于高分子化合物的是
A. 植物中所含的非常复杂的叶绿素 B. 石油分馏所得的重油中含有的C16H34
C. 植物油水解得到的高级脂肪酸 D. 芹菜中含有的粗糙的纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COS 和H2S 是许多煤化工产品的原料气。已知:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH=X kJ·mol-1;
H2S(g)+CO(g) ΔH=X kJ·mol-1;
I.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
(1)断裂1mol分子中的化学键所需吸收的能量如下表所示:
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/kJ·mol-1 | 1321 | 440 | 1076 | 680 | 930 | 1606 |
则X=_____________________。
(2)向10 L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应,在某温度下达到平衡,此时CO的体积分数为4%,且测得此时COS的物质的量为0.80mol,则该温度下反应I的平衡常数为_________________(保留两位有效数字)
(3)现有两个相同的2 L恒容绝热(与外界没有热量交换)密闭容器M、N,在M 中充入1mol CO和1molH2O,在N 中充入1molCO2和1molH2,均在700℃下开始按Ⅱ进行反应。达到平衡时,下列说法正确的是_________。
A.两容器中CO 的物质的量M>N
B.两容器中正反应速率M
C.容器M 中CO的转化率与容器N 中CO2的转化率之和小于1
D.两容器中反应的平衡常数M>N
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.4× 10-7 | 1.3×10-7 |
Ka2 | 4.7× 10-11 | 7.1×10-15 |
煤的气化过程中产生的H2S 可用足量的Na2CO3溶液吸收,该反应的离子方程式为______________;常温下,用100mL0.2mol·L-1InaOH溶液吸收448mL(标况)H2S气体,反应后溶液中离子浓度从大到小的顺序为__________________________________。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子 (M2+),所需S2-最低浓度的对数值1gc(S2-
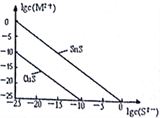
①25℃时Ksp(CuS)=_______________。
②25℃时向50mL的Sn2+、Cu2+浓度均为0.01mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为_____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是一种重要的化工原料,主要成分是CuFeS2,另外还有少量的氧化铝、二氧化硅及水分,通过化学工艺可获得许多化工产品。
(1)铜元素位于元素周期表中_________(填写周期、族);基态Fe原子的价层电子轨道表达式为_____;
(2)硫位于第VIA 族,该族元素氢化物沸点由低到高的顺序及原因是_________(必要化学用语及文字简答)。
(3)基态氮原子的第一电离能大于氧原子的第一电离能的原因是__________。
(4)由铝和氯元素组成的化合物熔点190℃、在熔融态不导电;该化合物易升华,其蒸气密度是相同条件下氢气的133.5倍。请写出其蒸气分子的结构式______________(如有配位键,请 用“→”表 示 )。(5)黄铜矿在空气中高温灼烧可以得到固体混合物和废气,固体混合物中有X和Y两化合物。固体化合物X的晶胞模型如图甲所示:
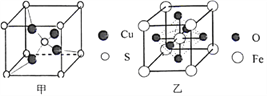
①化合物X的化学式:___________;
②废气中SO2经催化氧化生成SO3,SO3分子中硫原子杂化方式为___________;SO3分子空间构型是___________。
(6)黄铜矿高温灼烧得到的另一固体化合物Y的晶胞模型如图乙,已知丫晶体密度为ρg/cm3,则Y 晶体中晶胞边长是_____cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是
A. CO32-+H2O![]() HCO3-+OH-:用热的纯碱溶液清洗油污
HCO3-+OH-:用热的纯碱溶液清洗油污
B. A13++3H2O![]() Al(OH)3(胶体)+3H+:明矾净水
Al(OH)3(胶体)+3H+:明矾净水
C. TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+4HCl:制备TiO2纳米粉
TiO2·xH2O↓+4HCl:制备TiO2纳米粉
D. SnCl2+H2O![]() Sn( OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液
Sn( OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①固定好滴定管F并使滴定管尖嘴充满液体;
②用蒸馏水洗涤碱式滴定管F,并立即注入NaOH溶液至“0”刻度线以上;
③用标准液滴定至终点,记下滴定管液面读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤调节液面至“0”或“0”刻度线稍下,并记下读数。
请回答:
(1)以上步骤合理的顺序为(填编号)____________________,
(2)排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
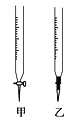

(3)滴定管F中应该选择右图中滴定管_____(填标号)。
(4)错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)
A.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗___________;
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确___________;
C.用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液___________;
D.配制标准溶液的NaOH中混有KOH杂质___________;
(5)滴定操作中,左手_____________,右手______________,眼睛应观察(填编号)_________A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(6)判断滴定终点的现象是:锥形瓶中溶液______________________________;
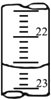
(7)如下图是某次滴定时的滴定管中的液面,其读数为________mL;
(8)根据下列数据:请计算待测盐酸溶液的浓度:______mol/L。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在研究元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
实验步骤 | 实验现象 |
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②向新制的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
④将镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究__________________元素性质递变规律。
(2)实验用品:试剂:金属钠、镁条、铝条、稀盐酸、新制氯水、新制Na2S溶液、AlCl3溶液、NaOH溶液、酚酞溶液等。
仪器:______、______、滤纸、试管夹、胶头滴管、镊子、小刀、玻璃片、砂纸、火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式及此实验的结论)
实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
实验现象(填A~F) | __ | __ | __ | __ | __ | __ |
①__________________________________________________;
②___________________________________________________;
此实验的结论:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为原电池示意图,回答下列问题:
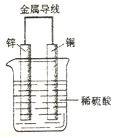
(1)该装置能够将_________能转化成电能。
(2)锌是原电池的_______极,放电过程中____(填“得”或“失”)电子,发生_______反应。
(3)电子是由_______极通过导线流向________极。
(4)铜电极的电极的反应式为____________________
(5)总反应的化学方程式为_______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com