
【题目】Ⅰ.某同学帮助水质检测站配制480mL0.5mol·L-1NaOH溶液以备使用。
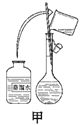
(1)其操作步骤如乙图所示,则甲图操作应在乙图中的______之间。
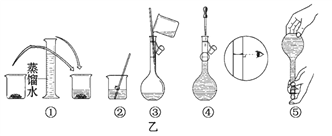
A.②与③ B.①与② C.③与④
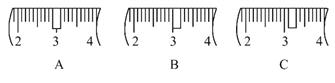
(2)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在在下图中选出能正确表示游码位置的选项________(填字母)。
Ⅱ.现有下列A、B、C三种常用化学仪器,请回答下列有关问题:
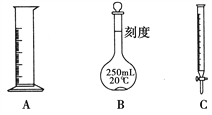
(1)三种化学仪器中标有“0”刻度的为________(填名称)。
(2)三种化学仪器在使用时首先需要检验是否漏液的为________(填字母代号)。
(3)用三种化学仪器中的一种对液体体积进行计量,正确的读数为n mL,仰视读数为x mL,俯视读数为y mL,若y>n>x,则所用量器是________(填名称)。
Ⅲ.化学课外活动小组设计了如下图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性。
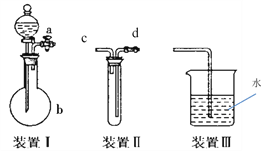
(1)实验前要检验装置Ⅰ的气密性,写出操作方法____________;
(2)利用装置Ⅱ可直接收集CO2,进气口为_____________。
(3)以上三个装置可组成实验室制取NH3,利用装置Ⅲ 吸收NH3时会发生倒吸,可向水中再加入一种液体可防止倒吸的发生,该液体为________(填化学式)。
【答案】 C 10.0 C 酸式滴定管 BC 量筒 先关闭活塞a,再由分液漏斗内向b中滴水,一段时间后若水不能滴下,证明装置气密性好 d CCl4
【解析】I.(1). 如图所示的操作为移液洗涤后向容量瓶内加水,应在转移溶液与定容之间;(2).根据m=cVM计算所需氢氧化钠的质量为10.0g,氢氧化钠具有腐蚀性且易潮解,应放在烧杯内称量,根据氢氧化钠与烧杯的总质量可知,游码应在3.1g的位置;
II. (1).酸式滴定管有0刻度;(2).有活塞或玻璃旋塞的仪器需要检验是否漏水;(3). 量取液体体积时,正确的读数为nmL,仰视时读数为xmL,俯视时读数为ymL,若y>n>x,说明容器上端刻度大;
III. (1).利用能否形成液柱差判断;(2). CO2的密度大于空气,用向上排空气法收集;(3). CCl4的密度大于水,将氨气通入CCl4中可防止倒吸。
I.(1). 如图所示的操作为移液洗涤后向容量瓶内加水,应在转移溶液与定容之间,即应在③和④之间,故答案选C;
(2). 实验室没有480mL容量瓶,所以应选500mL容量瓶配制溶液,配制500mL 0.5mol·L-1NaOH溶液需要氢氧化钠的质量为0.5L×0.5mol/L×40g/mol=10.0g;氢氧化钠具有腐蚀性且易潮解,应放在烧杯内称量,氢氧化钠与烧杯的总质量为10.0g+23.1g=33.1g,故应选择20g与10g的砝码,游码在3.1g的位置,故答案为:10.0;C;
II. (1). 标有0刻度的为酸式滴定管,故答案为:酸式滴定管;
(2). 带有活塞或玻璃旋塞的仪器要检查是否漏水,则酸式滴定管和容量瓶应检查是否漏水,故答案为:BC;
(3). 量取液体体积时,正确的读数为nmL,仰视时读数为xmL,俯视时读数为ymL,若y>n>x,说明容器上端刻度大,则量简符合,故答案为:量筒;
III. (1). 实验前要检验装置Ⅰ的气密性,可以先关闭活塞a,再由分液漏斗内向b中滴水,一段时间后若水不能滴下,证明装置气密性好,故答案为:先关闭活塞a,再由分液漏斗内向b中滴水,一段时间后若水不能滴下,证明装置气密性好;
(2). 因CO2的密度大于空气,所以用向上排空气法收集,则利用装置Ⅱ直接收集CO2,进气口为d,故答案为:d;
(3). 氨气不溶于CCl4,CCl4不溶于水且密度大于水,所以将氨气通入CCl4中可防止倒吸,故答案为:CCl4。


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M、N相比,较稳定的是 。
(2)已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式: 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:
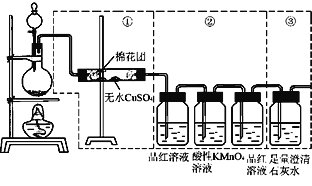
(1)浓硫酸与木炭粉在加热条件下的化学方程式为________________。
(2)如果装置中①、②、③三部分仪器的连接顺序改为②、①、③,则可以检验出的物质是________________;不能检出的物质是____________。
(3)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是_____________;不能检出的物质是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学教材中元素周期表的一部分,其中标出A~Q14种元素,试回答下列问题:

(1)在上表所列出的短周期元素中
①性质最不活泼的是____________;②原子半径最大的是(除稀有气体元素)__________。
③形成的气态氢化物最稳定的是______________________________;
④最高价氧化物对应的水化物中酸性最强的是____________碱性最强的是_____________。
⑤形成的阴离子还原性最弱的是_____________,阳离子半径最小的是_____________。
(2)①B的气态氢化物与最高价氧化物对应的水化物发生反应的化学方程式为________________;
②A单质与J的最高价氧化物对应的水化物反应的方程式________________________________。
(3)设P的原子序数为Z,则F的原子序数为______________,Q的原子序数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则p、q的关系正确的是
A. q=2p B. q>2p C. q<2p D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如图:

已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有________________(任写一种)。
(2)调节浸出液pH的范围为________,其目的是____________________。
(3)本工艺中可循环使用的物质是________(写化学式)。
(4)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成__________的结果。
Ⅱ.海水开发利用的部分过程如下图所示。

(1)海水中提取的NaCl中若混有少量的KClO3固体(KClO3溶解度随温度变化大),可通过______、________、_________的操作净化。
(2)生成Mg(OH)2用的沉淀剂一般是生石灰或熟石灰,所以Mg(OH)2沉淀中会混有Ca(OH)2,可通过反复洗涤去除Ca(OH)2,检验沉淀是否洗净的操作方法_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
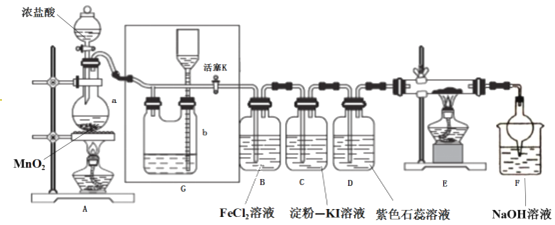
(1)A中发生反应的化学反应方程式为_________________________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置C、D中能看到的实验现象分别是 __________________ 、_______________ ;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为______________________________;
③装置F中球形干燥管的作用是____________________________;
(3)储气瓶b内盛放的试剂是______________________________;
(4)实验结束后,某同学想检验B瓶内液体是否完全与Cl2反应,可采用的方法是: __________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 70% Cu、25% Al、4% Fe 及少量 Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步Fe与过量的浓 HNO3 反应的离子方程式为_________,得到滤渣 1 的主要成分为__________。
(2)第②步加H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为Fe3+,用H2O2 做氧化剂的优点是______。
(3)滤渣 2 的主要成分是 Al(OH)3 和 Fe(OH)3,在生产中利用何种化学原理分离两种沉淀,写出反应的离子方程式_______。
(4)第③步蒸发所需玻璃仪器为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X、Y、Z的结构简式如下表所示。下列说法正确的是
X | Y | Z | |
结构简式 |
|
|
|
A. X的分子式为C8H7O3
B. X、Y、Z均可以和FeCl3发生显色反应
C. X、Y互为同系物,X、Z互为同分异构体
D. X、Y、Z在一定条件下都能发生取代反应、加成反应和氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com