
分析 (1)Fe3++SCN-=[Fe(SCN)]2+,加入NaF,有[Fe(SCN)]2++6F-=[FeF6]3-(无色)+SCN-;
(2)溶液存在Cu2++2H2O?Cu(H2O)4]2+和Cu2++4Cl-?[CuCl4]2-平衡,结合平衡移动解答.
解答 解:(1)Fe3++SCN-=[Fe(SCN)]2+,形成络合物,呈血红色,再加入NaF,有[Fe(SCN)]2++6F-=[FeF6]3-(无色)+SCN-,溶液重新变为无色.(因为[FeF6]3-比[Fe(SCN)]2+稳定许多),
答:溶液由血红色变为无色;
(2)溶液存在Cu2++2H2O?Cu(H2O)4]2+和Cu2++4Cl-?[CuCl4]2-平衡,取1支试管,加入1.5ml水,再加入少量CuCl2固体,振荡溶解后,溶液呈蓝色,逐滴加入浓盐酸,溶液变为黄色,然后逐滴加水稀释,变为蓝色,
答:加入少量CuCl2固体,振荡溶解后,溶液呈蓝色,发生Cu2++2H2O?Cu(H2O)4]2+,逐滴加入浓盐酸,发生Cu2++4Cl-?[CuCl4]2-,然后逐滴加水稀释,溶液又逐渐变为蓝色.
点评 本题考查化学平衡的移动,为高频考点,侧重于学生的分析能力的考查,注意把握离子的性质以及平衡移动的影响因素,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
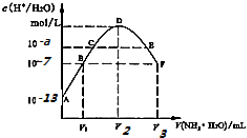
| A. | 稀硫酸的浓度为0.1mol/L | |
| B. | C点溶液pH=14-a | |
| C. | E溶液中存在:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | B到D、D到F所加氨水体积一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4在熔融状态下的电离方程为:NaHSO4═Na++H++SO42- | |
| B. | 在0.1m0L,L-1醋酸中加水,可使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大 | |
| C. | 升温可使电离平衡NH3•H2O?NH4++OH-向左移动 | |
| D. | 向氯水中加人少量氢氧化钠溶液可使溶液中的c(HClO)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3mol•L-1 | B. | 0.4mol•L-1 | C. | 0.2mol•L-1 | D. | 0.6mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.室温下,pH=11的氨水与pH=3的盐酸等体积混合:c(Cl﹣)=c(NH4+)>c(OH﹣)=c(H+)
B.醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO﹣)+c(CH3COOH)<c(Na+)
C.相同物质的量浓度的NaClO和NaHCO3混合溶液中:c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3)+c(CO32﹣)
D.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:实验题
50mL 1.Omol·L—1盐酸跟50mL 1.1mol·L—1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
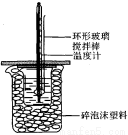
(1)大小烧杯间填满碎泡沫塑料的作用是_______________。
(2)_________(填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒。其原因是__________________。
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是________(填“偏高”“偏低”或“无影响”)。
(4)如果改用60mL 1.Omol·L—1盐酸跟50mL 1.1mol·L—1氢氧化钠溶液进行反应,则与上述实验相比,所放热量_______(填“增加” “减少”或“不变”),理由是_____________;所求中和热数值_________(填“增加”“减少”或“不变”),理由是_______________;
(5)________(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是______________________.
(6)Q=cm△t,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,△t表示反应前后溶液的温度的差值。该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
实验序号 | 起始温度t1/℃ | 终止温度/t2/℃ | 温差(t2-t1)/ ℃ |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.184×10—3kJ/(g·℃),则该反应的中和热为△H=____________(保留小数点后一位)。
(7)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是_______(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰 视读数
视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com