
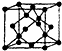
 X”¢Y”¢Z”¢W”¢R”¢QĪŖĒ°30ŗÅŌŖĖŲ£¬ĒŅŌ×ÓŠņŹżŅĄ“ĪŌö“ó£®XŹĒĖłÓŠŌŖĖŲÖŠŌ×Ó°ė¾¶×īŠ”µÄ£¬YÓŠČżøöÄܼ¶£¬ĒŅĆæøöÄܼ¶ÉĻµÄµē×ÓŹżĻąµČ£¬ZŌ×Óµ„µē×ÓŹżŌŚĶ¬ÖÜĘŚŌŖĖŲÖŠ×ī¶ą£¬WÓėZĶ¬ÖÜĘŚ£¬µŚŅ»µēĄėÄܱČZµÄµĶ£¬RÓėYĶ¬Ņ»Ö÷×壬QµÄ×īĶā²ćÖ»ÓŠŅ»øöµē×Ó£¬ĘäĖūµē×Ó²ćµē×Ó¾ł“¦ÓŚ±„ŗĶדĢ¬£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
X”¢Y”¢Z”¢W”¢R”¢QĪŖĒ°30ŗÅŌŖĖŲ£¬ĒŅŌ×ÓŠņŹżŅĄ“ĪŌö“ó£®XŹĒĖłÓŠŌŖĖŲÖŠŌ×Ó°ė¾¶×īŠ”µÄ£¬YÓŠČżøöÄܼ¶£¬ĒŅĆæøöÄܼ¶ÉĻµÄµē×ÓŹżĻąµČ£¬ZŌ×Óµ„µē×ÓŹżŌŚĶ¬ÖÜĘŚŌŖĖŲÖŠ×ī¶ą£¬WÓėZĶ¬ÖÜĘŚ£¬µŚŅ»µēĄėÄܱČZµÄµĶ£¬RÓėYĶ¬Ņ»Ö÷×壬QµÄ×īĶā²ćÖ»ÓŠŅ»øöµē×Ó£¬ĘäĖūµē×Ó²ćµē×Ó¾ł“¦ÓŚ±„ŗĶדĢ¬£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ·ÖĪö X”¢Y”¢Z”¢W”¢R”¢QĪŖĒ°30ŗÅŌŖĖŲ£¬ĒŅŌ×ÓŠņŹżŅĄ“ĪŌö“ó£®XŹĒĖłÓŠŌŖĖŲÖŠŌ×Ó°ė¾¶×īŠ”µÄ£¬ŌņXĪŖHŌŖĖŲ£»YÓŠČżøöÄܼ¶£¬ĒŅĆæøöÄܼ¶ÉĻµÄµē×ÓŹżĻąµČ£¬ŗĖĶāµē×ÓÅŲ¼ĪŖ1s22s22p2£¬¹ŹYĪŖCŌŖĖŲ£»RÓėYĶ¬Ņ»Ö÷×壬½įŗĻŌ×ÓŠņŹżæÉÖŖ£¬RĪŖSi£¬¶ųZŌ×Óµ„µē×ÓŹżŌŚĶ¬ÖÜĘŚŌŖĖŲÖŠ×ī¶ą£¬ŌņĶāĪ§µē×ÓÅŲ¼ĪŖns2np3£¬Ō×ÓŠņŹżŠ”ÓŚSi£¬¹ŹZĪŖNŌŖĖŲ£»WÓėZĶ¬ÖÜĘŚ£¬µŚŅ»µēĄėÄܱČZµÄµĶ£¬ŌņWĪŖOŌŖĖŲ£»QµÄ×īĶā²ćÖ»ÓŠŅ»øöµē×Ó£¬ĘäĖūµē×Ó²ćµē×Ó¾ł“¦ÓŚ±„ŗĶדĢ¬£¬²»æÉÄÜĪŖ¶ĢÖÜĘŚŌŖĖŲ£¬Ō×ÓŠņŹżŠ”ÓŚ30£¬¹ŹŗĖĶāµē×ÓÅŲ¼ĪŖ1s22s22p63s23p63d104s1£¬ŌņQĪŖCuŌŖĖŲ£¬¾Ż“Ė½ā“š£®
½ā“š ½ā£ŗX”¢Y”¢Z”¢W”¢R”¢QĪŖĒ°30ŗÅŌŖĖŲ£¬ĒŅŌ×ÓŠņŹżŅĄ“ĪŌö“ó£®XŹĒĖłÓŠŌŖĖŲÖŠŌ×Ó°ė¾¶×īŠ”µÄ£¬ŌņXĪŖHŌŖĖŲ£»YÓŠČżøöÄܼ¶£¬ĒŅĆæøöÄܼ¶ÉĻµÄµē×ÓŹżĻąµČ£¬ŗĖĶāµē×ÓÅŲ¼ĪŖ1s22s22p2£¬¹ŹYĪŖCŌŖĖŲ£»RÓėYĶ¬Ņ»Ö÷×壬½įŗĻŌ×ÓŠņŹżæÉÖŖ£¬RĪŖSi£¬¶ųZŌ×Óµ„µē×ÓŹżŌŚĶ¬ÖÜĘŚŌŖĖŲÖŠ×ī¶ą£¬ŌņĶāĪ§µē×ÓÅŲ¼ĪŖns2np3£¬Ō×ÓŠņŹżŠ”ÓŚSi£¬¹ŹZĪŖNŌŖĖŲ£»WÓėZĶ¬ÖÜĘŚ£¬µŚŅ»µēĄėÄܱČZµÄµĶ£¬ŌņWĪŖOŌŖĖŲ£»QµÄ×īĶā²ćÖ»ÓŠŅ»øöµē×Ó£¬ĘäĖūµē×Ó²ćµē×Ó¾ł“¦ÓŚ±„ŗĶדĢ¬£¬²»æÉÄÜĪŖ¶ĢÖÜĘŚŌŖĖŲ£¬Ō×ÓŠņŹżŠ”ÓŚ30£¬¹ŹŗĖĶāµē×ÓÅŲ¼ĪŖ1s22s22p63s23p63d104s1£¬ŌņQĪŖCuŌŖĖŲ£¬
£Ø1£©Cu+ŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ£ŗ1s22s22p63s23p63d10£¬
¹Ź“š°øĪŖ£ŗ1s22s22p63s23p63d10£»
£Ø2£©NO2-Ąė×ÓÖŠNŌ×Ó¹Āµē×Ó¶ŌŹżĪŖ$\frac{5+1-2”Į2}{2}$=1”¢¼Ū²ćµē×Ó¶ŌŹżĪŖ2+1=3£¬¹ŹĘäĮ¢Ģå¹¹ŠĶŹĒVŠĪ£¬
¹Ź“š°øĪŖ£ŗVŠĪ£»
£Ø3£©Y”¢RµÄ×īøß¼ŪŃõ»ÆĪļ·Ö±šĪŖ¶žŃõ»ÆĢ¼”¢¶žŃõ»Æ¹č£¬SiO2ĪŖŌ×Ó¾§Ģ壬CO2ĪŖ·Ö×Ó¾§Ģ壬¹Ź·Šµć½ĻøߵďĒ SiO2£¬
¹Ź“š°øĪŖ£ŗSiO2£» SiO2ĪŖŌ×Ó¾§Ģ壬CO2ĪŖ·Ö×Ó¾§Ģ壻
£Ø4£©½«Cuµ„ÖŹµÄ·ŪÄ©¼ÓČėµ½NH3µÄÅØČÜŅŗÖŠ£¬²¢ĶØČėO2£¬³ä·Ö·“Ó¦ŗóČÜŅŗ³ŹÉīĄ¶É«£¬·“Ӧɜ³É[Cu£ØNH3£©4]2+£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ2Cu+8NH3+O2+2H2O=2[Cu£ØNH3£©4]2++4OH-£¬
¹Ź“š°øĪŖ£ŗ2Cu+8NH3+O2+2H2O=2[Cu£ØNH3£©4]2++4OH-£»
£Ø5£©Ģ¼ÓŠ¶ąÖÖĶ¬ĖŲŅģŠĪĢ壬ĘäÖŠŅ»ÖÖĶ¬ĖŲŅģŠĪĢåµÄ¾§°ū½į¹¹ČēĶ¼£¬øĆ¾§ĢåŅ»øö¾§°ūµÄYŌ×ÓŹżĪŖ£ŗ4+8”Į$\frac{1}{8}$+6”Į$\frac{1}{2}$=8£»
ĆæøöYÓėÖÜĪ§µÄ4øöYŌ×ÓĻąĮŚ£¬¹ŹYŌ×ÓµÄÅäĪ»ŹżĪŖ4£»
Čō¾§°ūµÄ±ß³¤ĪŖa pm£¬Ōņ¾§°ūĢå»żĪŖ£Øa”Į10-10£©3cm3£¬¾§ĢåµÄĆܶČĪŖ¦Ń g/cm3£¬Ōņ¾§°ūÖŹĮæĪŖ£Øa”Į10-10£©3cm3”Į¦Ń g/cm3=¦Ńa3”Į10-30¦Ń g£¬Ōņ8”Į$\frac{12}{{N}_{A}}$g=¦Ńa3”Į10-30¦Ń g£¬¹ŹNA=$\frac{96”Į1{0}^{30}}{{a}^{3}•¦Ń}$£¬
¹Ź“š°øĪŖ£ŗ4£»$\frac{96”Į1{0}^{30}}{{a}^{3}•¦Ń}$£®
µćĘĄ ±¾ĢāŹĒ¶ŌĪļÖŹ½į¹¹µÄ漲飬Éę¼°ŗĖĶāµē×ÓÅŲ¼”¢ŌӻƹģµĄ”¢·Ö×Ó¹¹ŠĶ”¢¾§ĢåĄąŠĶÓėŠŌÖŹ”¢ÅäŗĻĪļ”¢¾§°ū½į¹¹Óė¼ĘĖćµČ£¬ŠčŅŖѧɜ¾ß±øŌśŹµµÄ»ł“”£¬ÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ½«Ė®¼ÓČČ£¬KWŌö“ó£¬pH²»±ä | |
| B£® | ĻņĖ®ÖŠ¼ÓČėÉŁĮæµÄNaOH¹ĢĢå£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬c£ØOH-£©½µµĶ | |
| C£® | ĻņĖ®ÖŠ¼ÓČėÉŁĮæµÄNH4Cl¹ĢĢå£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬ČÜŅŗ³Ź¼īŠŌ | |
| D£® | Ļņ0.1mol/LµÄ“×ĖįČÜŅŗÖŠ¼ÓČėŅ»¶ØĮæµÄ“×ĖįÄĘ¾§Ģ壬ČÜŅŗÖŠµÄc£ØOH-£©Ōö“ó£¬KW²»±ä |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | C4H8O3µÄ½į¹¹¼ņŹ½ĪŖHOCH2CH2CH2COOH | |
| B£® | C4H8O3µÄ½į¹¹¼ņŹ½ĪŖCH3CH£ØOH£©CH2COOH | |
| C£® | C4H8O3ĪŖ¦Į-ōĒ»ł¶”Ėį | |
| D£® | C4H8O3ĪŖōĒ»łŅŅĖįŅŅõ„ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĻņĮ×Ėį¶žĒāļ§ČÜŅŗÖŠ¼ÓČė×ćĮæĒāŃõ»ÆÄĘČÜŅŗ£ŗNH4++OH-ØTNH3•H2O | |
| B£® | ĻņĒāŃõ»ÆŃĒĢśÖŠ¼ÓČė×ćĮæµÄĻ”ĻõĖį£ŗFe£ØOH£©2+2H+ØTFe2++2H2O | |
| C£® | FeSO4ČÜŅŗŌŚæÕĘųÖŠ·ÅÖƱäÖŹ£ŗ4Fe2++O2+2H2OØT4Fe3++4OH- | |
| D£® | ¹żĮæSO2ĶØČėĄä°±Ė®ÖŠ£ŗSO2+NH3•H2O=HSO3-+NH4+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2C2H2£Øg£©+5O2£Øg£©ØT4CO2£Øg£©+2H2O£Øl£©”÷H=-389.9kJ•mol-1 | |
| B£® | 2C2H2£Øg£©+5O2£Øg£©ØT4CO2£Øg£©+2H2O£Øl£©”÷H=+2599.2kJ•mol-1 | |
| C£® | C2H2£Øg£©+$\frac{5}{2}$O2£Øg£©ØT2CO2£Øg£©+H2O£Øl£©”÷H=-1299.6kJ•mol-1 | |
| D£® | 2C2H2£Øg£©+5O2£Øg£©ØT4CO2£Øg£©+2H2O£Øl£©”÷H=-1299.6kJ•mol-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ČōÉś³ÉNAøöĖ®ÕōĘų·Ö×Ó·“Ó¦ČČĪŖ”÷H0£¬Ōņ”÷H0£¼”÷H | |
| B£® | µ±ÓŠ20NAøöµē×Ó×ŖŅĘŹ±£¬·Å³ö2600kJ ČČĮæ | |
| C£® | µ±ÓŠ4NAøöĢ¼Ńõ¹²ÓƵē×Ó¶ŌÉś³ÉŹ±£¬·Å³ö1300kJČČĮæ | |
| D£® | ÉĻŹö·“Ó¦ĪŖĪüČČ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  | B£® |  | ||
| C£® | 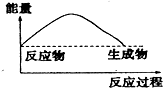 | D£® |  |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com