
| A. | SO2为0.4 mol•L-1、O2为0.2 mol•L-1 | |
| B. | SO2为0.25 mol•L-1 | |
| C. | SO2、SO3均为0.15 mol•L-1 | |
| D. | SO3为0.4 mol•L-1 |
分析 化学平衡研究的对象为可逆反应.化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:A.SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度浓度变化分别为0.2mol/L、0.1mol/L,因可逆反应,实际变化应小于该值,所以SO2小于 0.4mol/L,O2小于0.2mol/L,故A错误;
B.SO2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2的浓度浓度变化为0.2mol/L,该题中实际变化为0.05mol/L,小于0.2mol/L,故B正确;
C.反应物、生成物的浓度不可能同时减小,一个减小,另一个一定增大,故C错误;
D.SO3的浓度增大,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,SO3的浓度的浓度变化为0.2mol/L,实际变化小于该值,故D错误;
故选B.
点评 本题考查了化学平衡的建立,关键是利用可逆反应的不完全性,运用极限假设法解答,题目不难.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:解答题
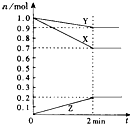 (1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为:3X+Y
(1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为:3X+Y 2Z
2Z查看答案和解析>>
科目:高中化学 来源: 题型:填空题
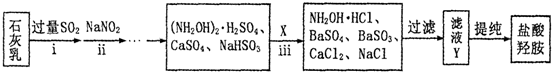
 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
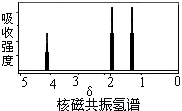
| A. | CH3COOCH2CH3 | B. | CH3CH=CHCH3 | C. | CH3CH2CH3 | D. | CH3CHOHCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
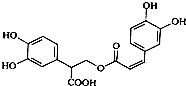
| A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸最多能和含6mol H2发生加成反应 | |
| C. | 迷迭香酸可以发生水解反应、消去反应和酯化反应 | |
| D. | 1mol迷迭香酸最多能和含6mol NaOH的水溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com