
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |


分析 (1)碳酸钙能与氢溴酸反应生成溴化钙、水和二氧化碳;CaCO3固体需有剩余,可使葡萄糖酸完全反应;
(2)趁热过滤,可避免葡萄糖酸钙的损失;
(3)由表中数据可知,葡萄糖酸钙微溶于乙醇,可避免损失;
(4)洗涤沉淀,应避免沉淀溶解,且能将沉淀吸附物冲洗去.
(5)须继续加入葡萄糖酸溶液至pH为5.8,抑制锌离子水解;
(6)步骤2为ZnO与葡萄糖酸的反应生成葡萄糖酸锌,不能引入新杂质,则加入不溶性含Zn元素的物质,且与酸反应即可.
解答 解:(1)碳酸钙能与氢溴酸反应生成溴化钙、水和二氧化碳,CaCO3+2HBr=CaBr2+CO2↑+H2O;可使葡萄糖酸完全转化为葡萄糖酸钙,则加入的碳酸钙应过量,
故答案为:CaCO3+2HBr=CaBr2+CO2↑+H2O;提高葡萄糖酸的转化率,便于后续分离;
(2)温度高时,葡萄糖酸钙的溶解度较大,趁热过滤,可避免葡萄糖酸钙的损失,
故答案为:葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品;
(3)由表中数据可知,葡萄糖酸钙微溶于乙醇,用乙醇洗涤可避免损失,有利于葡萄糖酸钙析出,
故答案为:可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出;
(4)洗涤沉淀,应避免沉淀溶解,且能将沉淀吸附物冲洗去,可用乙醇-水混合溶液,如只用水,则造成葡萄糖酸钙溶解而损失,只用乙醇,不能将杂质全被洗去;故答案为:d;
(5)因锌离子水解,则步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是抑制Zn2+的水解;
故答案为:抑制Zn2+的水解;
(6)a.NH3•H2O与葡萄糖酸反应后引入铵根离子,故a不选;
b.Zn(OH)2 与葡萄糖反应生成葡萄糖酸锌,且不引人杂质,故b选;
c.NaOH与葡萄糖酸反应后引入钠离子,故c不选;
d.ZnSO4与葡萄糖酸不反应,故d不选;
e.ZnCO3与葡萄糖反应生成葡萄糖酸锌,且不引人杂质,故e选;
故答案为:be.
点评 本题考查物质的制备、分离和提纯,着重于学生的分析能力和实验能力的考查,有利于培养学生的良好的科学素养,难度中等.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:解答题
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属的单质中,锂的还原性最强 | |
| B. | 第ⅠA族元素比第ⅡA族元素的金属性强 | |
| C. | 随着核电荷数的递增,卤族元素的气态氢化物的稳定性逐渐减弱 | |
| D. | 随着核电荷数的递增,第三周期元素的氧化物对应的水化物的酸性逐渐增强. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
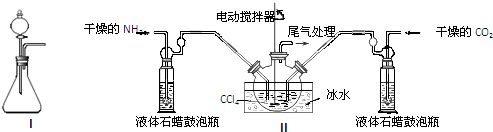
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 溶液不变浑浊,证明固体中不含碳酸铵. |
| 步骤3:向试管中继续加入少量澄清石灰水. | 溶液变浑浊,证明固体中含有碳酸氢铵. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-+S2-+2H+→HS-+H2O | B. | 2OH-+S2-+4H+→H2S↑+2H2O | ||
| C. | 2OH-+S2-+3H+→HS-+2H2O | D. | OH-+S2-+3H+→H2S↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯塑料制品可用于食品包装 | |
| B. | H7N9型禽流感病毒在高温条件下被杀死的过程是蛋白质变性 | |
| C. | 高纯度的硅单质用于制作光导纤维,光导纤维有导电性 | |
| D. | 研发使用高效催化剂,可提高反应中原料的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.尿素在农业生产中起重要作用,其合成过程分两步进行:
Ⅰ.尿素在农业生产中起重要作用,其合成过程分两步进行:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
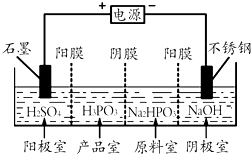 亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3.
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com