
【题目】二氧化铈(CeO2)是一种重要的稀士氧化物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下:

已知:①Ce4+能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
(1)焙烧过程中发生的主要反应方程式为____________________________________。
(2)“萃取”时存在反应:Ce4+ +n(HA)2![]() Ce·(H2n-4A2n)+4H+。
Ce·(H2n-4A2n)+4H+。
①实验室中萃取时用到的主要玻璃仪器为烧杯和__________________。
②右图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:____________________________________ 。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:____________________________________ 。
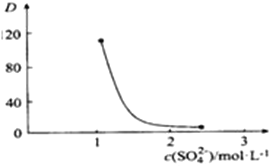
③在D=80的条件下,取20mL含四价铈总浓度为0. 1mol/L的酸浸液,向其中加入10mL萃取剂(HA)2,充分振荡,静置,水层中c(CeSO42+)=_________。 (结果保留三位有效数字)
(3) “反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作用与下列反应中H2O2的作用相同的是____________。
A. H2O2和MnO2混合制O2 B.用H2O2处理含酸性K2Cr2O7的废水
C.H2O2和CaO混合制备CaO2 D.用稀硫酸和H2O2的混合液溶解金属Cu
(4)溶液中c(Ce3+)等于1.0×10-5mol·L-1,可认为Ce3+沉淀完全,此时溶液的pH为______________,
(已知298K时,Ksp[Ce(OH)3]=1.0×10-20);“氧化过滤”步骤中氧化过程的离子方程式为 _____________________________________ 。
(5)取上述流程中得到的CeO2产品m g,加硫酸溶解后,加入V1mL a mol/L FeSO4溶液(足量),使铈被还原为Ce3+ (其它杂质均不反应,Ce3+为无色),用bmol/L的标准酸性KMnO4溶液去滴定过量的FeSO4,消耗标准溶液V2mL,则该产品中CeO2的质量分数为______ %;下列选项可能使测定结果偏低的是__________。
A.滴定前平视读数,滴定终点时仰视读数
B.滴定时锥形瓶内溶液变红就立即停止滴定
C.滴定管尖嘴部分滴定前无气泡,滴定终点有气泡
【答案】 4CeFCO3+ O2+2Na2CO3![]() 4 CeO2+ 4NaF+6CO2 分液漏斗 随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,导致萃取平衡向生成[CeSO4]2+的方向移动,D迅速减小 2.44×10-3mol/L B 9 2Ce(OH)3+ClO-+H2O=2Ce(OH)4+Cl- 17.2(aV1-5bV2)/m A
4 CeO2+ 4NaF+6CO2 分液漏斗 随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,导致萃取平衡向生成[CeSO4]2+的方向移动,D迅速减小 2.44×10-3mol/L B 9 2Ce(OH)3+ClO-+H2O=2Ce(OH)4+Cl- 17.2(aV1-5bV2)/m A
【解析】氟碳铈矿(主要含CeFCO3),经和碳酸钠焙烧,+3价铈氧化成+4价,水洗除去NaF,加过量硫酸酸浸,酸浸液中含有Ce4+,加萃取剂,Ce4+被萃取剂[(HA)2]萃取,加反萃取剂,加H2O2,又将Ce4+还原为Ce3+,发生反应4Ce4++H2O2=4Ce3++O2↑+2H+,加碱后Ce3+转化为沉淀,加NaClO将铈从+3价氧化为+4价,得到产品。结合以上分析:
(1)焙烧过程中发生的主要反应方程式为4CeFCO3+ O2+2Na2CO3![]() 4 CeO2+ 4NaF+6CO2。
4 CeO2+ 4NaF+6CO2。
(2)①萃取时用到的主要玻璃仪器为烧杯和分液漏斗 。
②“萃取”时存在反应:Ce4++n(HA)2![]() Ce·(H2n-4A2n)+4H+。随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,导致萃取平衡向生成[CeSO4]2+的方向移动,D迅速减小。
Ce·(H2n-4A2n)+4H+。随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,导致萃取平衡向生成[CeSO4]2+的方向移动,D迅速减小。
③D=80,![]() =80,即c[Ce·(H2n-4A2n)]=80c(CeSO42+),依据题意有:0.1mol/L×20×10-3L=20×10-3L× c(CeSO42+)+10×10-3L×80 c(CeSO42+),解得c(CeSO42+)=2.44×10-3mol/L。
=80,即c[Ce·(H2n-4A2n)]=80c(CeSO42+),依据题意有:0.1mol/L×20×10-3L=20×10-3L× c(CeSO42+)+10×10-3L×80 c(CeSO42+),解得c(CeSO42+)=2.44×10-3mol/L。
(3)在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2作还原剂,A. H2O2和MnO2混合制O2 ,H2O2既作氧化剂又作还原剂,A不符合题意;B.用H2O2处理含酸性K2Cr2O7的废水,H2O2作还原剂,符合题意;C.H2O2和CaO混合制备CaO2,H2O2既不作氧化剂又不作还原剂,C不符合题意; D.用稀硫酸和H2O2的混合液溶解金属Cu,H2O2作氧化剂,D不符合题意;综合以上分析,本题选B。
(4)Ksp[Ce(OH)3]=c(Ce3+)![]() c3(OH-)=1.0×10-20,c3(OH-)=
c3(OH-)=1.0×10-20,c3(OH-)=![]() =10-15,则c(OH-)=10-5mol/L
=10-15,则c(OH-)=10-5mol/L
c(H+)=10-9mol/L,所以pH=9;“氧化过滤”步骤中ClO-作氧化剂,Ce(OH)3 被氧化为Ce(OH)4,则氧化过程的离子方程式为2Ce(OH)3+ClO-+H2O=2Ce(OH)4+span>Cl-。
(5)根据电子得失守恒,CeO2 ![]() FeSO4 ; KMnO4
FeSO4 ; KMnO4 ![]() 5 FeSO4;由所给数据知与KMnO4反应的FeSO4的物质的量=5bmol/L×V2×10-3L,则与CeO2反应的FeSO4的物质的量=amol/L×V1×10-3L-5bmol/L×V2×10-3L=(aV1-5bV2)×10-3mol,即n(CeO2)=n(FeSO4)= (aV1-5bV2)×10-3mol ,产品中CeO2的质量分数为17.2(aV1-5bV2)/m %;根据实验原理分析,A.滴定前平视读数,滴定终点时仰视读数,读取的KMnO4溶液体积偏大,即V2偏大,使测定结果偏低,符合题意;B.滴定时锥形瓶内溶液变红就立即停止滴定,V2偏小,使测定结果偏高,不符合题意;C.滴定管尖嘴部分滴定前无气泡,滴定终点有气泡,V2偏小,使测定结果偏高,不符合题意;综合以上分析,本题答案为17.2(aV1-5bV2)/m ;A。
5 FeSO4;由所给数据知与KMnO4反应的FeSO4的物质的量=5bmol/L×V2×10-3L,则与CeO2反应的FeSO4的物质的量=amol/L×V1×10-3L-5bmol/L×V2×10-3L=(aV1-5bV2)×10-3mol,即n(CeO2)=n(FeSO4)= (aV1-5bV2)×10-3mol ,产品中CeO2的质量分数为17.2(aV1-5bV2)/m %;根据实验原理分析,A.滴定前平视读数,滴定终点时仰视读数,读取的KMnO4溶液体积偏大,即V2偏大,使测定结果偏低,符合题意;B.滴定时锥形瓶内溶液变红就立即停止滴定,V2偏小,使测定结果偏高,不符合题意;C.滴定管尖嘴部分滴定前无气泡,滴定终点有气泡,V2偏小,使测定结果偏高,不符合题意;综合以上分析,本题答案为17.2(aV1-5bV2)/m ;A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列离子的检验方法正确的是( )
A. 某溶液![]() 产生白色沉淀,说明原溶液中有Cl-
产生白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 产生白色沉淀,说明原溶液中有SO
产生白色沉淀,说明原溶液中有SO![]()
C. 某溶液![]() 产生蓝色沉淀,说明原溶液中有Cu2+
产生蓝色沉淀,说明原溶液中有Cu2+
D. 某溶液![]() 生成无色气体,说明原溶液中有CO
生成无色气体,说明原溶液中有CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①②均为工业上的重要反应。
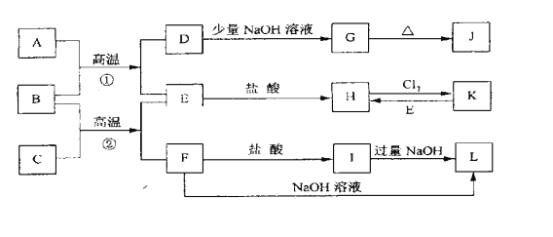
请回答下列问题:
(1)写出下列物质的化学式:D___________;K____________;L______________。
(2)写出B与C高温反应生成E和F的化学方程式:_______________________。
(3)写出D与J的稀溶液反应生成G的离子方程式:______________________。
(4)写出H转化为K的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2+能与NH3、H2O、C1-等形成配位数为4的配合物。
(1)[Cu(NH3)4]2+中存在的化学键类型有____(填序号)。
A.配位链 B.极性共价键 C.非极性共价键 D.离子键
(2)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为________________________________。
(3)某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2![]() CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为____________。
CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3的性质说法正确的是
A. 溶解度:Na2CO3>NaHCO3
B. 右图所示装置可证明稳定性:Na2CO3>NaHCO3
C. 用澄清石灰水可鉴别Na2CO3溶液和NaHCO3溶液
D. 等质量的Na2CO3和NaHCO3分别与过量盐酸反应,放CO2质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q为短周期非金属元素,R是长周期元素。X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+只有三个电子层且完全充满电子。请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为 。
(2)X、Y、Z三种元素第一电离能从大到小顺序为 。
(3)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键):
![]()
①该分子中两个Y原子之间的键型组合正确的是 。
A.仅1个σ键
B.1个σ键和2个π键
C.1个σ键和1个π键
D.仅2个σ键
②该分子中Y原子的杂化方式是 。
(4)X与Y元素可以形成一种超硬新材料,其晶体部分结构如下图所示,有关该晶体的说法正确的是 。

A.该晶体属于分子晶体
B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时共价键被破坏,没有克服范德华力和氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在碱性溶液中可发生如下反应:R(OH)3+2ClO﹣+4OH﹣═RO4n﹣+3Cl﹣+5H2O.则RO4n﹣ 中R的化合价是( )
A.+7
B.+6
C.+5
D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素原子的核外电子排布决定了元素在元素周期表中的位置,已知某元素原子的核外电子排布式为1s22s22p63s23p63d34s2。该元素位于元素周期表
A. 第4周期第ⅤB族 B. 第4周期第ⅡA族
C. 第2周期第ⅡB族 D. 第5周期第ⅡB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探 究,并共同回答下列问题:
探究一:设计如图所示装置进行“铁与水反应”的实验(夹持仪器略).
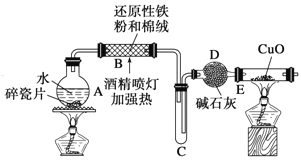
(1)硬质玻璃管 B 中发生反应的化学方程式为:________________________________.。
(2)反应前 A 中投放碎瓷片的目的是___________________.。
(3)装置 E 中的现象是_______________________。
探究二:设计如下实验方案确定反应后硬质玻璃管 B 中黑色固体的成分。
(4)待硬质玻璃管 B 冷却后,取少许其中的固体物质溶于___________________后,将所得溶液分成两份。
(5)一份滴加几滴 KSCN 溶液。若溶液变血红色,推断硬质玻璃管 B 中固体物质的成分为______________________(选 填序号,下同);若溶液未变血红色,推断硬质玻璃管 B 中固体物质的成分为__________________________________。
①一定有 Fe3O4 ②一定有 Fe ③只有 Fe3O4 ④只有 Fe
(6)另一份用_____(填仪器名称)加入_____(填试剂和现象),可以 证明溶液中存在 Fe2+。
探究三:设计如下流程测定反应后硬质玻璃管 B 中固体含铁元素的质量分数。
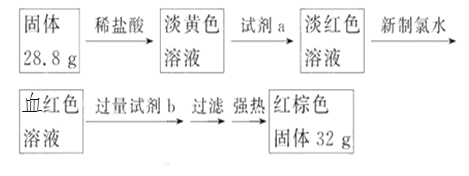
(7)试剂 b 的化学式是_____。
(8)计算反应后 B 装置中铁元素的质量分数为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com