
| A. | 气态氢化物的稳定性:HCl>HBr>HI | B. | 离子半径:S2->Na+>O2- | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 熔点:SiO2>NaCl>干冰 |
分析 A、非金属性越强,氢化物越稳定;
B、电子层数越多半径越大,电子层数相同时核电荷数越多半径越小;
C、中心元素非金属性越强,最高价氧化物对应水化物的酸性越强;
D、不同类型的晶体熔点:原子晶体>离子晶体>分子晶体.
解答 解:A、非金属性:Cl>Br>I,因此氢化物的稳定性:HCl>HBr>HI,故A正确;
B、相同电子层结构的微粒,核电核数大的半径小,O2->Na+,即S2->O2->Na+,故B错误;
C、非金属性:Cl>S>P,则最高价含氧酸酸性:HClO4>H2SO4>H3PO4,故C正确;
D、SiO2是原子晶体,NaCl是离子晶体,干冰是分子晶体,一般有熔点:原子晶体>离子晶体>分子晶体,故D正确;
故选B.
点评 本题考查同周期及同主族元素性质的递变规律、晶体类型与性质、半径比较等,难度中等,注意规律的掌握与理解.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
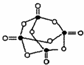 所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH
所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH (PAN)等二次污染物.
(PAN)等二次污染物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三聚氰胺(分子式:C3H6N6)含氮量很高,可作为牛奶添加剂 | |
| B. | 聚氯乙烯能使溴的四氯化碳溶液褪色 | |
| C. | 为了减少“白色污染”,我国规定商家不得提供塑料袋 | |
| D. | 低碳生活就是节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
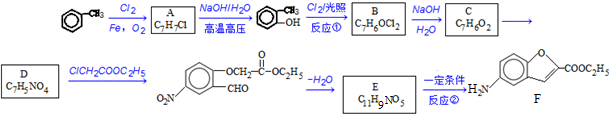
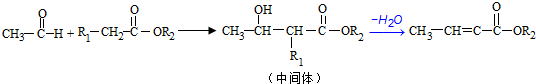
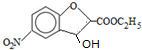 ;反应①的反应类型为取代反应;
;反应①的反应类型为取代反应;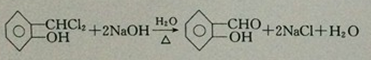 ;ClCH2COOC2H2加热条件下与足量NaOH反应后酸化所得有机物,发生聚合反应的化学方程式为
;ClCH2COOC2H2加热条件下与足量NaOH反应后酸化所得有机物,发生聚合反应的化学方程式为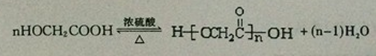 ;
;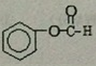 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目 的 | 操作或现象 |
| A | 制备无水FeCl3 | 将FeCl3溶液加热蒸干 |
| B | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C | 证明非金属性Cl>C>Si | 向碳酸钠溶液中加盐酸产生气体,将气体先通过饱和NaHCO3溶液,再通入硅酸钠溶液时产生白色沉淀 |
| D | 测定NaCl中混有Na2CO3的量 | 取一定量样品加入足量稀硫酸,将产生的气体直接用足量碱石灰吸收,测得其增重,便可求得原样品中Na2CO3的量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.4 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 400 | 500 | 800 | 1 000 |
| K | 2.6 | 1.6 | 1.0 | 0.40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com