
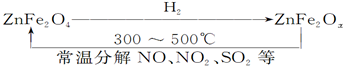
分析 (1)①该反应硝酸中部分N元素化合价由+5价变为+2、+4价,部分N元素化合价不变,据此判断硝酸性质;
②利用电子守恒来计算作氧化剂的硝酸的物质的量,作酸性和作氧化剂的物质的量之和为参加反应的硝酸的物质的量;
(2)①该反应中P元素化合价由0价变为+5价、Cl元素化合价由+5价变为-1价,根据转移电子守恒及原子守恒配平方程式;
②根据转移电子守恒计算硫酸铜氧化白磷的物质的量;
(3)根据得失电子守恒和化学式中元素化合价代数和为零计算,铁酸锌高温下被氢气还原生成氧缺位铁酸锌和水.
解答 解:(1)①该反应硝酸中部分N元素化合价由+5价变为+2、+4价,部分N元素化合价不变,所以硝酸体现氧化性和酸性,故答案为:氧化性和酸性;
②n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,
设NO的物质的量为n,得到的NO和NO2物质的量相同,
由电子守恒可知,0.3mol×2=n×(5-2)+n×(5-4),
解得n=0.15mol,
由N原子守恒可知作氧化剂的硝酸为0.15mol+0.15mol=0.3mol,
由Cu(NO3)2可知,作酸性的硝酸为0.3mol×2=0.6mol,
则参加反应的硝酸的物质的量是0.3mol+0.6mol=0.9mol,
故答案为:0.9mol;
(2)①反应中P元素的化合价由0价升高到+5价,Cl元素的化合价由+5价降低到-1价,根据得失电子数目相等可知二者计量数之比为3:10,则结合质量守恒定律可知平衡后的化学方程式为3P4+10HClO3+18H2O=10HCl+12H3PO4,
故答案为:3;10;18H2O;10;12;
②30mol硫酸铜转移电子物质的量=30mol×(2-0)=60mol,氧化白磷物质的量=$\frac{60mol}{4×(5-0)}$=1.5mol,故答案为:1.5mol;
(3)新型纳米材料ZnFe2OX可由化合物ZnFe2O4经高温还原制得,若2mol ZnFe2OX与SO2反应可生成0.75molS,则ZnFe2OX被还原为ZnFe2O4,令中铁元素的化合价为a,根据电子转移守恒,可知2mol×2×(3-a)=0.75mol×4,解得,a=2.25,利用化合价代数和为零,2+2.25×2=2x,解得x=3.25,
铁酸锌高温下被氢气还原生成氧缺位铁酸锌和水,该反应为4ZnFe2O4+3H2 $\frac{\underline{\;高温\;}}{\;}$4ZnFe2O3.25+3H2O,
故答案为:3.25;4ZnFe2O4+3H2$\frac{\underline{\;高温\;}}{\;}$4ZnFe2O3.25+3H2O.
点评 本题涉及氧化还原反应计算、化学方程式的配平等知识点,较综合,把握题干中信息及发生的化学反应是解本题关键,题目难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯气是无色、有刺激性气味的有毒气体 | |
| B. | 氯气在常压下冷却到-34.6℃变成液氯,它是易液化的气体之一 | |
| C. | 氢气在氯气中燃烧火焰呈淡蓝色 | |
| D. | 红热的铜丝放人氯气中生成绿色的氯化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有一透明溶液,可能含有较大量的NH4+、Fe3+、Na+、SO42-、CO32-、H+、Mg2+、Al3+、Cu2+中的某一种或几种,取此溶液做下列试验
有一透明溶液,可能含有较大量的NH4+、Fe3+、Na+、SO42-、CO32-、H+、Mg2+、Al3+、Cu2+中的某一种或几种,取此溶液做下列试验查看答案和解析>>
科目:高中化学 来源: 题型:填空题
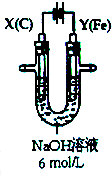 用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.
用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30mL | B. | 55mL | C. | 65mL | D. | 175mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极反应为2n-2e-+20H一═Zn(OH)2 | |
| B. | 充电时,阴极pH增大 | |
| C. | 放电时,若有6mol电子转移,则正极有10 mol OH一移向负极 | |
| D. | 充电时,阳极反应为Fe(OH)3+50H一+3e一=Fe042-+4H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两元素均位于元素周期表中第4周期Ⅷ族 | |
| B. | 两者均能被潮湿空气腐蚀 | |
| C. | 氧化性:Cu2+>Fe3+>Fe2+ | |
| D. | 铁丝和铜丝在氯气里燃烧均生成二价氯化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com