
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
【答案】15 g 43.8%
【解析】
向氯化钠、碘化钠的混合物溶液中通入足量氯气后,可发生如下反应:
2NaI+Cl2=2NaCl+I2
溶液蒸干时,I2易升华,那么最后剩余的固体是NaCl。
(1)混合物中增加氯元素的质量,减少了碘元素的质量。原混合物中碘化钠的质量是X。
固体差量是26.7 g -17.55 g =9.15 g。
2NaI+Cl2=2NaCl+I2....差量
300......117.......183
X.................9.15
得X=15g,即原混合物中碘化钠的质量是15 g。
(2) 原混合物中氯化钠的质量是26.7 g -15 g =11.7g
则原混合物中氯化钠的质量分数=![]() =43.8%。
=43.8%。


科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 将稀硫酸和碳酸钠反应生成的气体通入一定浓度的硅酸钠溶液中 | 出现白色胶状沉淀 | 酸性:H2SO4 >H2CO3> H2SiO3 |
B | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液变为红色 | 溶液中一定含有Fe2+ |
C | 加热盛有氯化铵固体的试管 | 试管底部固体消失,试管口有晶体凝结 | 氯化铵固体可以升华 |
D | 向硫酸铜溶液中通入氯化氢气体 | 溶液的蓝色褪去,生成黑色沉淀 | 氢硫酸的酸性比硫酸强 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①CH4、②C2H2、③C2H4、④C2H6、⑤苯中
(1)能使酸性高锰酸钾溶液褪色的是__________。(填序号,下同)
(2)相同物质的量,在氧气中完全燃烧时消耗氧气最多的是________;
(3)相同质量,在氧气中完全燃烧时消耗氧气最多的是____,耗氧量、生成CO2和水都相等的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇、氧气和强碱溶液做电解质的手机电池中的反应:2CH3OH+3O2+4OH-![]() 2CO32-+6H2O,有关说法正确的是( )
2CO32-+6H2O,有关说法正确的是( )
A. 放电时,负极电极反应:CH3OH+8OH--6e-=== CO32-+6H2O
B. 放电时,CH3OH参与反应的电极为正极
C. 标况下,通入11.2 L O2完全反应有1 mol电子转移
D. 充电时电解质溶液的pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若把周期表原先的主、副族号取消,由左到右按原顺序编为18纵行。如碱金属为第1纵行,稀有气体为第18纵行,按这个规定,下列说法不正确的是( )
A.计算机芯片的组成元素位于第14纵行
B.第10纵行元素全部是金属元素
C.第18纵行元素单质全部是气体
D.只有第2纵行元素的原子最外层有2个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g),反应过程如下图所示,下列说法正确的是
2NH3(g),反应过程如下图所示,下列说法正确的是

A. t1 min时正、逆反应速率相等
B. X曲线表示NH3的物质的量随时间变化的关系
C. 0~8 min,H2的平均反应速率v(H2)=3/4 mol·L-1·min-1
D. 10~12 min,N2的平均反应速率v(N2)=0.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系如图,下列说法正确的是( )
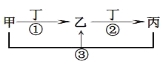
A.若丁为用量最大,用途最广的金属单质,乙的溶液一定为FeCl3
B.若通常情况下甲、乙、丙、丁都是气体,且乙和丁为空气的主要成分,则反应①的化学方程式4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C.若甲、乙、丙的溶液显碱性,丙可作为医疗上治疗胃酸过多症的药剂,将等物质的量的乙和丙溶于水形成混合溶液,溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)> c(H+)
D.若丁为化合物,且为氯碱工业的重要产品,则甲一定为含Al3+的盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小块钠投入盛饱和澄清石灰水的烧杯里,不可能观察到的现象是
A.钠熔成小球并在液面上游动
B.溶液底部有银白色物质生成
C.有气体生成
D.溶液变浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com