
| A.催化剂通过降低化学反应的焓变加快化学反应速率 |
| B.铅蓄电池充电时.标有“一”的电极应与电源的负极相连 |
| C.温度保持不变.向水中加入钠盐对水的电离一定没有影响 |
| D.向醋酸钠溶液中加水稀释时.溶液中所有离子浓度都减小 |
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.利用电池外壳的金属材料 |
| B.回收其中的石墨电极 |
| C.防止电池中的汞、镉和铅等重金属离子对土壤和水的污染 |
| D.不使电池中渗泄的电解液腐蚀其它物品 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 4CO(g) + BaS(s) △H1 =+571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 =+571.2 kJ·mol-1 ① 2CO2(g) + BaS(s) △H2=+226.2 kJ·mol-1 ②
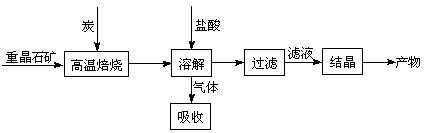
2CO2(g) + BaS(s) △H2=+226.2 kJ·mol-1 ②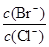 = 。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
= 。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10] 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
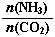 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
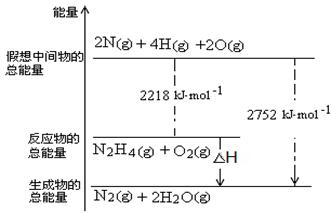
 2NH3(g)ΔH=-92.4 kJ·mol-1
2NH3(g)ΔH=-92.4 kJ·mol-1
| A.2c1>1.5mol·L-1 | B.w3=w1 | C.2ρ1=ρ2 | D.K甲= K乙= K丙 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。
2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。 4NH3(g)+3O2(g) △H=Q。
4NH3(g)+3O2(g) △H=Q。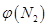 与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。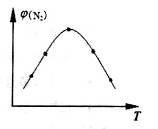

 2NH3(g) △H=-93.0kJ/mol。
2NH3(g) △H=-93.0kJ/mol。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2CH3OH(g) △H= 37Kj·mol-1
2CH3OH(g) △H= 37Kj·mol-1 3 H2(g)+CO2(g) △H =49Kj·mol-1
3 H2(g)+CO2(g) △H =49Kj·mol-1 CO(g) +H2O(g) △H=41.3Kj·mol-1
CO(g) +H2O(g) △H=41.3Kj·mol-1 CH3OH(g) △H <0。现将l0mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(
CH3OH(g) △H <0。现将l0mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(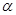 )与温度、压强的关系如下图所示。
)与温度、压强的关系如下图所示。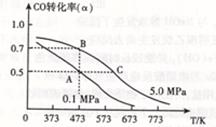
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
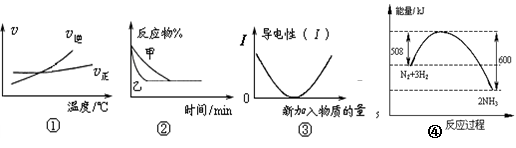
A.根据图①可判断可逆反应 “ A2(g)+3B2(g) 2AB3(g)” 的ΔH>0 2AB3(g)” 的ΔH>0 |
B.图②表示压强对可逆反应2A(g)+ 2B(g) 3C(g)+ D(s)的影响,乙的压强大 3C(g)+ D(s)的影响,乙的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D.图④是N2与H2合成氨的能量变化曲线,可确定该反应1 mol N2和3 mol H2充分反应时放热一定小于92 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 |
| B.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解 |
| C.向纯水中加入盐酸或降温都能使水的离子积减小,电离平衡逆向移动 |
| D.反应2A(g) + B(g) =" 3C" (s) + D(g)在一定条件下能自发进行,说明该反应的ΔH>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com