
| A.铜是正极,铜片上有气泡产生 |
| B.电子由锌流向铜电极,锌被氧化,质量减小 |
| C.电流方向是从锌电极流向铜电极 |
| D.铜电极被还原,铜片质量增大 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
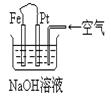
| A.这是电解NaOH溶液的装置 |
| B.这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2 沉淀的颜色 |
| C.Pt为正极,其电极反应为:O2+2H2O +4e-=4OH- |
D.Fe为阳极,其电极反应 为:Fe-2e-+2OH-=2Fe(OH)2 为:Fe-2e-+2OH-=2Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.I和III | B.I和IV |
| C.II和III | D.II和IV |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.正极附近SO42-的浓度逐渐增大 | B.负极附近SO42-的浓度逐渐减小 |
| C.负极附近SO42-的浓度逐渐增大 | D.正负极附近SO42-的浓度基本不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Ag + Fe3+设计成如下图所示的原电池。下列判断错误的是
Ag + Fe3+设计成如下图所示的原电池。下列判断错误的是
| A.反应开始时,电子从甲中石墨经导线流向乙中石墨 |
| B.电流计指针为零时,上述反应的正反应速率等于逆反应速率 |
| C.电流计读数为零后,在甲中加入FeCl3固体,乙中石墨电极反应为Ag - e- ="=" Ag+ |
| D.电流计读数为零后,在乙中加入硫化钠固体,电流计指针读数仍为零 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.正极发生反应是:O2+2H2O+4e-→4OH- |
| B.参加反应的C2H6与O2的物质的量之比为7:2 |
| C.放电一段时间后,KOH的物质的量浓度将下降 |
| D.在电解质溶液中阳离子向正极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com