
| A. | 降低温度可以加快反应速率 | |
| B. | 使用合适的催化剂可以加快反应的速率 | |
| C. | 在上述条件下,氢气能全部转化为氨气 | |
| D. | 达到平衡时,体系中各物质的浓度一定相等 |
分析 对于可逆反应,反应物不可能全部转化为生成物,在反应中,加入催化剂、增大反应物浓度都可增大反应速率,达到平衡状态时,正逆反应速率相等,各物质的浓度不变,以此解答.
解答 解:A.降温,化学反应速率减慢,故A错误;
B.加入催化剂,降低反应的活化能,增大活化分子的百分数,可增大反应速率,故B正确;
C.该反应为可逆反应,反应物不可能全部转化为生成物,故C错误;
D.达到平衡状态时,正逆反应速率相等,各物质的浓度不变但不一定相等,故D错误;
故选B.
点评 本题考查化学反应速率的影响以及化学平衡状态的判断等问题,为高考常见题型和高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意把握可逆反应的特点,难度不大.


科目:高中化学 来源: 题型:填空题
| 代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 半径(pm) | 30 | 64 | 66 | 91 | 70 | 106 | 110 | 186 | 125 | 232 |
| 主要 化合价 | -1,+1 | -1 | -2 | -4, +4 | -3, +5 | -2,+4,+6 | -4, +4 | +1 | +3 | +1 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

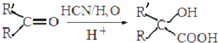
 生成
生成 的反应类型是取代反应.
的反应类型是取代反应. .
. .
.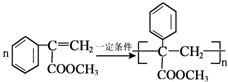 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na和Na+的化学性质相似 | |
| B. | 钠在空气中燃烧生成氧化钠 | |
| C. | 钠可与硫酸铜溶液反应得到铜 | |
| D. | 实验室通常把钠保存在石蜡油或煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠、钾着火时用水灭火 | |
| B. | 点燃氢气前要验纯,点燃甲烷前不必验纯 | |
| C. | 浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上浓硫酸 | |
| D. | 稀释浓硫酸时,为防止液体飞溅,将浓硫酸沿烧杯壁缓缓加入水中,并不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH2O所含的电子数目为9N0 | |
| B. | 0.1 mol/L Na2SO4溶液所含Na+数目为0.2N0 | |
| C. | 1 mol钠完全反应时所失去的电子数为N0 | |
| D. | 标准状况下22.4L O2所含的原子数目为N0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| I | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| II | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| III | 900 | 2 | 1 | a | b | t |
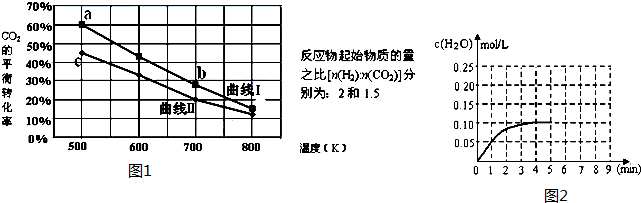
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液可用于刻制印刷铜电路板 | |
| B. | Na2O2常用于潜水艇或呼吸面具的供氧剂 | |
| C. | 明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| D. | 二氧化硅可做半导体材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com