
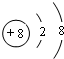 ,C为碳元素,在周期表的位置为第二周期第ⅣA族,故答案为:
,C为碳元素,在周期表的位置为第二周期第ⅣA族,故答案为: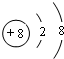 ;第二周期第ⅣA族;
;第二周期第ⅣA族;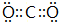 ;E与D的单质在常温下反应的生成物为Na2O,由钠离子与氯离子构成,其电子式为
;E与D的单质在常温下反应的生成物为Na2O,由钠离子与氯离子构成,其电子式为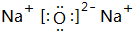 ,E与D按原子数1:1化合而成的物质为Na2O2,所含化学键有:离子键、共价键,
,E与D按原子数1:1化合而成的物质为Na2O2,所含化学键有:离子键、共价键,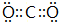 ;
;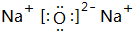 ;离子键、共价键;
;离子键、共价键;

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、醋酸钠水解反应的离子方程式为:CH3COO-+H2O=CH3COOH+OH- |
| B、某无色透明溶液中:Na+、MnO4-、SO42-、CO32-能大量共存 |
| C、在pH=4的NH4Cl溶液中:c(H+)+c(NH4+)>c(Cl-)+c(OH-) |
| D、等pH等体积的醋酸和盐酸分别与足量的锌反应,前者产生的H2多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A_和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A_和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| IA | 0 | |||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | ⅦA | |
| 2 | ⑩ | ② | ③ | ④ | ⑧ | |||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 除杂试剂 | 离子方程式 | 操作 | |
| (1)BaCl2(HCl) | 过量 |
过滤 | |
| (2)Cu(Zn) | |||
| (3)SiO2(Al2O3) | |||
| (4)CO(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属铝溶于氢氧化钠溶液:2Al+6OH-=2AlO2-+3H2↑ |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、用FeCl3溶液腐蚀铜电路板:Fe3++Cu=Fe2++Cu2+ |
| D、铜片加入浓硝酸中:Cu+4H++2NO3-=Cu2++2H2O+2NO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com