
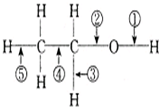
 乙醇在一定条件下发生化学反应时化学键断裂如下图所示.下列说法不正确的是( )
乙醇在一定条件下发生化学反应时化学键断裂如下图所示.下列说法不正确的是( )| 反应 | 反应类型 | 断键位置 | |
| A | 乙醇与金属钠 | 置换 | ① |
| B | 乙醇/浓硫酸170℃ | 消去 | ②⑤ |
| C | 乙醇/浓氢溴酸加热 | 取代 | ① |
| 乙醇与乙酸/浓硫酸加热 | 酯化 | ① | |
| D | 乙醇/Cu Ag加热 | 催化氧化 | ①③ |
| 燃烧 | 氧化 | ①②③④⑤ |
| A、A | B、B | C、C | D、D |
| ||
| 170℃ |
| ||
| △ |
| ||
| △ |


科目:高中化学 来源: 题型:
| A、碳酸、苯酚、甲酸、乙酸 |
| B、甲酸、乙酸、碳酸、苯酚 |
| C、甲酸、碳酸、苯酚、乙酸 |
| D、苯酚、碳酸、乙酸、甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤ | B、①④⑤⑥ |
| C、②③④⑥ | D、①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2S+SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为2:1 | ||||
| B、4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O中,氧化剂和还原剂物质的量之比为5:2 | ||||
C、3I2+6KOH
| ||||
D、2FeS+6H2SO4(浓)
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A、0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L?min) |
| B、6~10min的平均反应速率:v(H202)<3.3×10-2mol/(L?min) |
| C、反应至6min时,c(H2O2)=0.30mol/L |
| D、反应至6min时,H2O2分解了50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
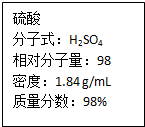 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com