
| A、在NaHA溶液中一定有:c(Na+)>c(HA-)>c(OH-)>c(H+) |
| B、0.1mol/L(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
| C、0.2 mol?L-1CH3COOH溶液和0.2 mol?L-1CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol?L-1 |
| D、pH相等的①NH4Cl ②(NH4)2SO4③NH4HSO4溶液中,c (NH4+)大小顺序为①=②>③ |


科目:高中化学 来源: 题型:

| A、气体甲一定是纯净物 |
| B、沉淀甲是硅酸和硅酸钙的混合物 |
| C、K+、AlO2-、SiO32-、和CO32-一定存在于溶液X中 |
| D、SO42-一定不存在于溶液X中 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、锌片作负极,质量逐渐减少 |
| B、电子由铜片沿导线流向锌片 |
| C、铜电极逐渐溶解 |
| D、该装置能将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
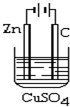 电解原理在工业有广泛的应用.利用相关知识回答下面的问题.
电解原理在工业有广泛的应用.利用相关知识回答下面的问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl沉淀生成和沉淀溶解不断进行,但速率相等 |
| B、AgCl难溶于水,溶液中没有Ag+和Cl- |
| C、在AgCl的澄清饱和溶液中,只要向其中加入NaCl溶液,一定会有沉淀生成 |
| D、向含有AgCl沉淀的悬浊液中加入NaCl固体,AgCl的溶解度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Al3+、Cl-、AlO2- |
| B、Mg2+ NO3- Fe2+、H+ |
| C、Fe3+、SO42-、Na+、SCN- |
| D、K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、R原子的电子层数比N的电子层数多1 |
| B、R元素的最高正化合价与NO3-中的N的化合价相等 |
| C、RO3-和NO3-都只能被还原,不能被氧化 |
| D、R和N为同族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C3H6、CH2=CHCH3 |
B、-OH、 |
C、 、 、 |
D、 、1s22s22p63s23p6 、1s22s22p63s23p6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com