
【题目】某小组同学在实验室研究铝与氯化铜溶液的反应。
实验操作 | 实验现象 |
| ①红色物质附着于铝片表面 ②铝片表面逸出大量无色气体,放出大量的热 ③烧杯底部出现红色沉淀和白色沉淀 |
(1)打磨铝片的目的是__________。
(2)现象①和现象③中的红色物质均为Cu,生成该物质的化学方程式为______________。
(3)经检验,现象②中的无色气体为氢气。甲同学猜测可能是氯化铜溶液显酸性,经pH计检验,pH_____7,证实了甲的猜想。
(4)探究白色沉淀的化学成分。
乙同学通过查阅资料认为白色沉淀可能是氯化亚铜(CuCl)。
CuCl中铜元素的化合价是________。
【查阅资料】
①CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl-。
②Cu(NH3)2+在空气中易被氧化变为蓝色;Cl-可与硝酸银溶液反应,产生白色沉淀。
【进行实验】
①取烧杯底部的白色沉淀,充分洗涤;
②向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
③取其中一份无色溶液……
④将另一份无色溶液放置于空气中……
以上步骤③的实验方案是________;步骤④的现象是________。
【得出结论】通过实验可以确定,该白色固体是CuCl。
【反思与评价】Al和CuCl2溶液反应为什么会出现CuCl呢?
丙同学猜测:可能是Cu与CuCl2溶液反应生成了CuCl。
丙同学为了验证猜想,取Cu粉与15% CuCl2溶液混合,无白色沉淀产生。
(5)丙通过分析Al与CuCl2溶液反应的实验现象,改进了实验,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是________。
(6)丁同学认为丙同学的实验还不够严谨,还应考虑________对Cu与CuCl2溶液反应的影响。
【答案】 除去表面氧化铝 2Al+ 3CuCl2 =3 Cu +2 AlCl3 < +1 向其中滴加硝酸银溶液 变为蓝色 将Cu与CuCl2溶液混合并加热 AlCl3
【解析】(1)由于铝在空气中易与氧气反应形成一层氧化铝模,打磨铝片的目的是除去表面氧化铝;
(2)由于铝的活动性大于铜,铝会与氯化铜溶液反应生成氯化铝和铜,化学方程式为:2Al+ 3CuCl2 =3Cu +2AlCl3;
(3)酸性溶液的pH<7;
(4)氯化亚铜(CuCl)中氯元素的化合价为-l价,设氯化亚铜(CuCl)中铜元素的化合价为x,根据化合物中正负化合价的代数和为0,则
x+(-1)=0
解得x=+1,
根据资料需要验证步骤②中溶液是否有Cu(NH3)2+和Cl-。步骤④将另一份无色溶液放置于空气中,会变为蓝色,证明含有Cu(NH3)2+;所以步骤③要证明Cl-,故向其中滴加硝酸银溶液;
(5)铝和氯化铜溶液反应过程中有白色沉淀生成,反应过程放出大量热量,证明了Cu与CuCl2溶液反应生成CuCl,可以加热观察是否生成白色沉淀,若加热出现沉淀说明Cu与CuCl2溶液反应生成了CuCl,若不出现沉淀说明Cu与CuCl2溶液不能反应生成了CuCl;
(6)由于实验中存在氯化铝,还要考虑氯化铝对实验可能带来的影响。


科目:高中化学 来源: 题型:
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: ①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使凹液面处于“0”刻度以下的位置,记下读数;
②将锥形瓶用蒸馏水洗净后,直接从碱式滴定管中放入20.00mL待测溶液到锥形瓶中;
③将酸式滴定管用蒸馏水洗净后,立即向其中注入0.2000mol/L标准稀硫酸溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;
向锥形瓶中滴入几滴酚酞作指示剂,进行滴定,测出所耗硫酸的体积;
⑤重复以上过程.
试回答下列问题:
(1)当滴入最后一滴稀硫酸时, , 可判断达到滴定终点.
(2)滴定过程中,下列会导致滴定结果偏低的是
A.若记录读数时,起始时仰视,终点时俯视
B.滴定前向锥形瓶中加入10mL蒸馏水,其余操作正常
C.若配制硫酸时,定容时俯视刻度,其他操作正常
D.酸式滴定管在装酸液前未用待测硫酸溶液润洗
E.开始实验时碱式滴定管尖嘴部分有气泡,滴定结束气泡消失
(3)测定操作中有一步存在问题,该步骤是:(填序号)
(4)根据下列数据:
滴定次数 | 待测液体积(mL) | 标准硫酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.50 | 25.45 |
第二次 | 20.00 | 4.00 | 29.05 |
第三次 | 20.00 | 3.00 | 30.00 |
第四次 | 20.00 | 2.00 | 27.00 |
请计算待测烧碱溶液的浓度为mol/L.
(5)为了测定产品中(NH4)2Cr2O7的含量,称取样品0.150 0g,置于锥形瓶中,加50mL水,再加入2g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min,加入3mL 0.5%淀粉溶液并稀释成250ml溶液,取25ml该溶液,用0.010 0mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL,则上述产品中(NH4)2Cr2O7的纯度为 . (假定杂质不参加反应,已知:①Cr2O72﹣+6I﹣+14H+=2Cr3++3I2+7H2O,I2+2S2O32﹣=2I﹣+S4O62﹣;②(NH4)2Cr2O7的摩尔质量为252g/moL).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为短周期元素,原子序数依次增大.其中A与E同主族,B的最外层电子数是次外层电子数的2倍,C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X.A、B、D、E可组成化合物A2D2、B2A2、E2D2 , 它们都含有非极性共价键.
(1)C元素在周期表中的位置是 , 写出B的最高价氧化物的电子式 .
(2)X的水溶液显(填“酸”、“碱”或“中”)性,理由是(用离子方程式表示) , 溶液中各种离子浓度由大到小的顺序为 .
(3)A、B、D、E四种元素组成的化合物中原子个数最少的化合物的化学式为 .
(4)火箭推进器中装有液态的C2A4和液态A2D2 , 它们发生化学反应时生成气态C单质和水蒸气,并放出大量的热.已知0.4mol液态C2A4跟液态A2D2完全反应时,放出256.6kJ热量,该反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙烯和苯的性质的叙述中,错误的是( )
A.乙烯能使溴水褪色
B.乙烯能使酸性高锰酸钾溶液褪色
C.将苯加入溴水中,因苯能与溴水发生加成反应而使溴水褪色
D.50~60℃时,在浓硫酸存在下,苯能与浓硝酸反应生成硝基苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于反应:mA(g)+nB(g)cC(g)+dD(g),C物质的质量分数(C%)与温度、压强的关系如图所示,下列判断正确的是( ) 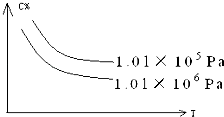
A.△H<0△S>0
B.△H>0△S<0
C.△H>0△S>0
D.△H<0△S<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com