



 、
、 、HOCH2CH2OH,B发生氧化反应得到E,B系列转化反应得到H,A转化得到D,可推知D为HOCH2CH2OH,E为
、HOCH2CH2OH,B发生氧化反应得到E,B系列转化反应得到H,A转化得到D,可推知D为HOCH2CH2OH,E为 ,H为
,H为 ,由转化关系可知,烃A为CH2=CH2,A与溴发生加成反应生成C为BrCH2CH2Br,C在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH2OH,B为
,由转化关系可知,烃A为CH2=CH2,A与溴发生加成反应生成C为BrCH2CH2Br,C在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH2OH,B为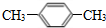 ,F为
,F为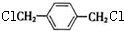 ,F发生水解反应生成G为
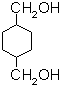
,F发生水解反应生成G为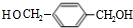 ,G与氢气发生加成反应生成H,环保塑料与甲醇反应得到D、H、I,则I为
,G与氢气发生加成反应生成H,环保塑料与甲醇反应得到D、H、I,则I为 ,据此解答.
,据此解答. ,
, ,HOCH2CH2OH,B发生氧化反应得到E,B系列转化反应得到H,A转化得到D,可推知D为HOCH2CH2OH,E为
,HOCH2CH2OH,B发生氧化反应得到E,B系列转化反应得到H,A转化得到D,可推知D为HOCH2CH2OH,E为 ,H为
,H为 ,由转化关系可知,烃A为CH2=CH2,A与溴发生加成反应生成C为BrCH2CH2Br,C在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH2OH,B为
,由转化关系可知,烃A为CH2=CH2,A与溴发生加成反应生成C为BrCH2CH2Br,C在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH2OH,B为 ,F为
,F为 ,F发生水解反应生成G为
,F发生水解反应生成G为 ,G与氢气发生加成反应生成H,环保塑料与甲醇反应得到D、H、I,则I为
,G与氢气发生加成反应生成H,环保塑料与甲醇反应得到D、H、I,则I为 ,
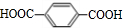
, ,故答案为:
,故答案为: ;
; ;B为
;B为 ,名称为:对二甲苯;试剂X为:氢氧化钠水溶液,
,名称为:对二甲苯;试剂X为:氢氧化钠水溶液, ;对二甲苯;氢氧化钠水溶液;
;对二甲苯;氢氧化钠水溶液;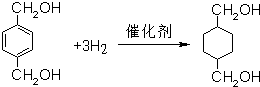 ,故答案为:
,故答案为: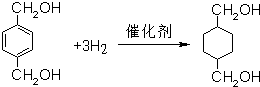 ;
;| 水 |
| △ |
| 水 |
| △ |


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
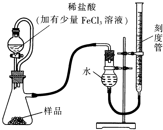 镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量.某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量.
镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量.某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量.查看答案和解析>>
科目:高中化学 来源: 题型:
| 3n |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有碳碳双键的有机物均有顺反异构 |
| B、乙烯和聚乙烯均能使酸性KMnO4溶液褪色 |
| C、利用电石与水反应制取C2H2时,可采用CuSO4溶液除去杂质气体 |
| D、苯酚与甲醇在酸性条件下聚合生成酚醛树脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com