
����Ŀ����1.0 L�����ܱ������з���0.10 mol X����һ���¶��·�����Ӧ��X(g)![]() Y(g)��Z(g) ��H��0��������������ѹǿp�淴Ӧʱ��t�ı仯��ϵ��ͼ��ʾ�����·�����ȷ���� ( )
Y(g)��Z(g) ��H��0��������������ѹǿp�淴Ӧʱ��t�ı仯��ϵ��ͼ��ʾ�����·�����ȷ���� ( )

A. ���¶��´˷�Ӧ��ƽ�ⳣ��K��3.2
B. �ӷ�Ӧ��ʼ��t1ʱ��ƽ����Ӧ����v(X)��0.2/t1 mol��L��1��min��1
C. �����ƽ����ϵ��Y�İٷֺ������ɼ���һ������X
D. �����������䣬�ٳ���0.1 mol����X��ƽ�������ƶ���X��ת���ʼ���
���𰸡�D
��������
X(g)![]() Y(g)��Z(g)
Y(g)��Z(g)
��ʼ 0.1 0 0
�仯 b b b
t1minĩ 0.1-b b b
����ѹǿ�ȵ������ʵ����ȣ�![]() ��b=0.04��
��b=0.04��
X(g)![]() Y(g)��Z(g)
Y(g)��Z(g)
��ʼ 0.1 0 0
ת�� a a a
ƽ�� 0.1-a a a
����ѹǿ�ȵ������ʵ����ȣ�![]() ��a=0.08��
��a=0.08��
A. ���¶��´˷�Ӧ��ƽ�ⳣ��K��![]() 0.32����A����
0.32����A����
B. �ӷ�Ӧ��ʼ��t1ʱ��ƽ����Ӧ����v(X)![]() ��0.04/t1 mol��L��1��min��1����B����
��0.04/t1 mol��L��1��min��1����B����
C.�������м���һ������X���൱�ڼ�ѹ��Y�İٷֺ�����С����C����
D. �����������䣬�ٳ���0.1 mol����X��ƽ�������ƶ��� ������X��ת���ʣ��൱�ڼ�ѹ��X��ת���ʼ��٣���D��ȷ��


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���ļ������γ�(���)1 mol��ѧ��ʱ�ͷ�(������)����������֪����P4O6�ķ��ӽṹ��ͼ��ʾ�����ṩ���»�ѧ���ļ���(kJ/mol) P��P��198��P��O��360��O��O��498����ӦP4(����)+3O2![]() P4O6
P4O6
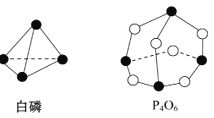
A. �ų�1 638 kJ����
B. ����1 638 kJ����
C. �ų�126 kJ����
D. ����126 kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֶ�����Ԫ�أ����ǵĽṹ�����ʵ���Ϣ���±�������
Ԫ�� | �ṹ�����ʵ���Ϣ |
A | �Ƕ������У���ϡ�������⣩ԭ�Ӱ뾶����Ԫ�أ���Ԫ�ص�ij�ֺϽ���ԭ�ӷ�Ӧ�ѵĵ��ȼ� |
B | B��Aͬ���ڣ�������������ˮ��������� |
C | Ԫ�ص���̬�⻯�K������ˮ������������� |
D | �Ǻ�ˮ�г��⡢��Ԫ���⺬������Ԫ�أ��䵥�ʻ���Ҳ������ˮ���������г��õ�����ɱ���� |
����ݱ�����Ϣ��д��
��1��Aԭ�ӵĺ�������Ų�ʽ____________��
��2��BԪ�������ڱ��е�λ��____________�����Ӱ뾶��B____________A����������������С��������ԭ�Ӱ뾶��B____________C����������������С��������
��3��Cԭ�ӵĵ����Ų�ͼ��____________����ԭ�Ӻ�����____________��δ�ɶԵ��ӣ�������ߵĵ���Ϊ____________����ϵĵ��ӣ�������____________�Σ�
��4��D���Ľṹʾ��ͼ��____________����һ������D____________A����������������С��������
��5��C�����еĻ�ѧ��Ϊ____________���������Լ��������Ǽ��Լ�������1molC����̬�⻯���к���____________mol�Ҽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
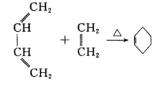
����Ŀ����������������һ�־��в�����ζ��ʳ�����ϣ���ϳ�·����ͼ��

��֪����.
��.RMgBr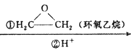 RCH3CH2OH+
RCH3CH2OH+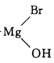
�ش��������⣺
��1��A�����������ŵ�������__��H��һ��ͬ���칹���ܷ���������Ӧ���仯ѧ������__���ѧ���ƣ���
��2��G�Ľṹ��ʽ��__��G��I�ķ�Ӧ������__��
��3��E��F�Ļ�ѧ����ʽ��__��
��4��I��һ�������¿ɺϳɸ߷���M����M�Ľṹ��ʽ��__��
��5��E��һ�������·�����ȥ��Ӧ�û�����N��N��CH2=CHCH=CH2�ڼ��������·�Ӧ����Ľṹ��ʽ��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ȼ��仯��������ѧ��ѧ��Ҫ����ɲ��֡�
��1������ȼ�ϵ��ʹ�õĵ������Һ��KOH��Һ����ط�ӦΪ��4NH3+3O2��2N2+6H2O���õ�ظ����ĵ缫��ӦʽΪ__________���øõ�ؽ��д�ͭ����Al��Zn��Ag��Pt��Au�����ʣ��ĵ�⾫������CuSO4��ҺΪ�������Һ������˵����ȷ����________��
a������ȫ��ת��Ϊ��ѧ��
b��SO42�������ʵ���Ũ�Ȳ��䣨��������Һ����仯��
c����Һ��Cu2+�������ƶ�
d������������ɻ���Ag��Pt��Au�Ƚ���
e����������������64g����ת�Ƶ�����Ϊ2NA��
��2���ٽ�SO2ͨ�뵽BaCl2��Һ�У��������쳣�����������Եİ�ɫ������Ϊ̽���ð�ɫ�����ijɷ֣������������ʵ�����̣���������Һ![]() ��ɫ����
��ɫ����![]() �۲������жϣ����Լ�A�Ļ�ѧʽΪ_________��ʵ������������Լ�A��ɫ����δ���ܽ⣬�����ð�ɫ���������ӷ���ʽ��________��
�۲������жϣ����Լ�A�Ļ�ѧʽΪ_________��ʵ������������Լ�A��ɫ����δ���ܽ⣬�����ð�ɫ���������ӷ���ʽ��________��
��������ͼ��ʾ�绯ѧװ�����չ�ҵβ����SO2������������Cu��д��װ���������ĵ缫��Ӧʽ_________��
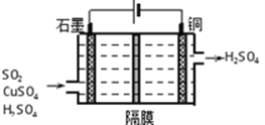
��3����֪Ksp��BaSO4��=1.0��10��10��Ksp��BaCO3��=2.5��10-9��ijͬѧ�������������̵õ�BaCl2��BaSO4![]() BaSO3
BaSO3![]() BaCl2����ٵ����ӷ���ʽΪ________���÷�Ӧ��ƽ�ⳣ��K=_________��
BaCl2����ٵ����ӷ���ʽΪ________���÷�Ӧ��ƽ�ⳣ��K=_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����![]()
A.��ˮϡ��![]()
![]() ��Һ����Һ���������ӵ�Ũ�Ⱦ���С
��Һ����Һ���������ӵ�Ũ�Ⱦ���С
B.![]() mol
mol![]() ͨ������ˮ�У�ת�Ƶ��ӵ���ĿΪ
ͨ������ˮ�У�ת�Ƶ��ӵ���ĿΪ![]()
C.��Ӧ![]() �ڳ����²����Է����У�˵���÷�Ӧ��
�ڳ����²����Է����У�˵���÷�Ӧ��![]()
D.�������ͭʱ���������Դ������������ͭ���Դ�ĸ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ʾһЩ�����е�ijЩ�ṹ�����Ƿֱ���NaCl��CsCl���ɱ������ʯ��ʯī����ṹ�е�ijһ�ֵ�ijһ���֡�
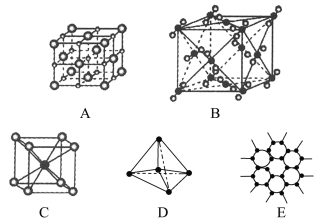
(1)���д������ʯ����(������ĸ����ͬ)________������ÿ��̼ԭ����________��̼ԭ����ӽ��Ҿ�����ȡ����ʯ����________���塣
(2)���д���ʯī����________������ÿ����������ռ��̼ԭ����ƽ��Ϊ________����
(3)���д���NaCl�������________��ÿ��Na����Χ������ӽ��Ҿ�����ȵ�Na����________����
(4)����CsCl�������________��������________���壬ÿ��Cs����________��Cl�����ڡ�
(5)�����ɱ�����________��������________���壬ÿ��CO2������________��CO2���ӽ��ڡ�
(6)�������������۵��ɸߵ��͵�����˳��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D���Ƕ�����Ԫ�أ�AԪ�ص�ԭ�Ӻ������������Ӳ㣬������Ѵﵽ���ͣ�BԪ��λ��AԪ�ص���һ���ڣ������ĵ�������AԪ��������������![]() ��CԪ�ص����Ӵ���������λ����ɣ����ĺ�������Ų���AԪ��ԭ����ͬ��DԪ����CԪ����ͬһ���ڣ�DԪ��ԭ�ӵ�������������C��������������1��
��CԪ�ص����Ӵ���������λ����ɣ����ĺ�������Ų���AԪ��ԭ����ͬ��DԪ����CԪ����ͬһ���ڣ�DԪ��ԭ�ӵ�������������C��������������1��
�������������ж�
��1��A______��B______��C______��D______����Ԫ�ط��ţ���
��2��BԪ��λ�ڵ�_______����_______�壬B�����������Ļ�ѧʽ��______��������������ˮ������һ��______�ᣨ��ǿ��������
��3����C��D�ĵ����У�����ˮ��Ӧ�Ͼ��ҵķ�Ӧ�����ӷ���ʽ��______��
��4��C���ӵĺ�������Ų�ʽΪ______��Dԭ�ӵĺ�������Ų�ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������A�Ƿ���ʽΪ![]() ����Ԫ��״������˴Ź�������������壬��������֮��Ϊ
����Ԫ��״������˴Ź�������������壬��������֮��Ϊ![]() ������ͼ��ʾ��ת����
������ͼ��ʾ��ת����
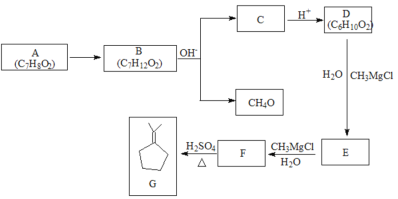
��֪��
![]() ���ʻ��Ļ��������������Լ��������·�Ӧ��
���ʻ��Ļ��������������Լ��������·�Ӧ��![]()
![]()
![]()
![]() �����ǻ�����ͬһ̼ԭ���ϼ����ȶ�������ˮ��
�����ǻ�����ͬһ̼ԭ���ϼ����ȶ�������ˮ�� ��
��![]() +H2O
+H2O
����������Ϣ���ش��������⣺
![]() д��������D�й����ŵ�����________��
д��������D�й����ŵ�����________��
![]() д��������B��F�Ľṹ��ʽ________��________��
д��������B��F�Ľṹ��ʽ________��________��
![]() �ķ�Ӧ������________��
�ķ�Ӧ������________��
![]() �D��
д��D��![]() ��Ӧ�Ļ�ѧ����ʽ________________
��Ӧ�Ļ�ѧ����ʽ________________![]() д��
д��![]() �Ļ�ѧ����ʽ_______________________��
�Ļ�ѧ����ʽ_______________________��
![]() �����ڷ����廯�����ͬ���칹����________�֣�д����������������A��һ��ͬ���칹��W�Ľṹ��ʽ________��
�����ڷ����廯�����ͬ���칹����________�֣�д����������������A��һ��ͬ���칹��W�Ľṹ��ʽ________��![]() �����������칹
�����������칹![]()
![]() ��������ȡ����
��������ȡ���� ![]() �����ϵ�һ�ȴ���ֻ������
�����ϵ�һ�ȴ���ֻ������ ![]() �������������Ʒ�Ӧ����
�������������Ʒ�Ӧ����![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com