
单质Z是一种常见的半导体材料,可由X通过如图所示的路线制备,其中X为Z的氧化物;Y为氢化物,分子结构与甲烷相似,回答下列问题:
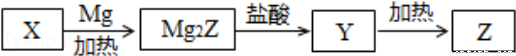
(1)能与X发生化学反应的酸是 ;由X制备Mg2Z的化学方程式为 ;
(2)由Mg2Z生成Y的化学方程式为 ,Y分子的电子式为 。
(3)Z、X中共价键的类型分别是 、 。
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源:2015-2016学年广西钦州港经济开发区中学高二上12月月考化学试卷(解析版) 题型:填空题
空气污染监测仪是根据SO 2 与Br 2 的定量反应测定空气中SO 2 的含量:SO 2 +Br 2 + 2H 2 O==H 2 SO 4 +2HBr,上述反应的溴,来自一个装满酸性KBr溶液的电解槽阳极上的氧化反应。电解槽的阴、阳极室是隔开的。当测空气中SO 2 的含量时,空气(经过除尘)以1.5×10 - 4 m 3·min - 1 的流速进入电解槽的阳极室,电流计显示每秒通过的电子是8.56×10 - 1 1mol时,此条件下能保持溴浓度恒定,并恰与SO 2 完全反应(设被测空气中不含与溴反应的物质)。
(1)写出监测过程中主要发生的化学反应方程式;_______________________。
(2)计算空气中SO 2 的含量(g·m - 3 空气)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省高三上学期第六次考试理综化学试卷(解析版) 题型:选择题
化学与生产、生活息息相关,下列叙述错误的是
A.浓硫酸可刻蚀石英制艺术品
B.铁表面镀锌可增强其抗腐蚀性
C.大量燃烧化石燃料是造成雾霾天气的一种重要因素
D.氢氧化铝可作胃酸的中和剂
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上1月阶段测理综化学试卷(解析版) 题型:填空题
矿物燃料在使用的过程中会产生大量污染性物质,如SO2和CO2,而H2和NH3都被认为是理想的清洁能源。
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2═MH2x(s)△H<0(M表示某种合金)如图1表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系.则下列说法中,正确的是___________;
a.T1>T2
b.增大氢气压强,加快氢气的吸收速率
c.增大M的量,上述平衡向右移动
d.上述反应可实现多次储存和释放氢气
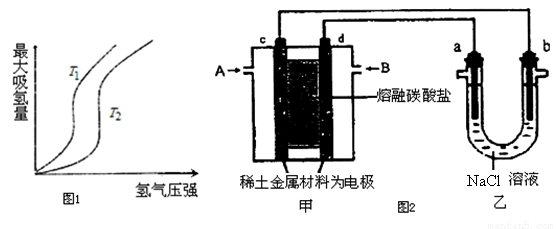
(2)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如图2装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体.图2乙装置中a、b为石墨电极,电解一段时间后,b电极附近滴入酚酞溶液变红,NaCl溶液的体积为100mL。
①工作过程中,甲装置中d电极上的电极反应式是________________;乙装置中电极a为_______极(填电极名称)。
②若在a极产生112mL(标准状况)气体,25℃时乙装置中所得溶液pH=__________。(忽略电解前后溶液的体积变化)
(3)氨在氧气中燃烧,生成水和一种空气组成成分的单质.
已知:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1 2H2(g)+O2(g)═2H2O(1)△H=-572KJ•mo1-1试写出氨气在氧气中燃烧生成液态水的热化学方程式________________;
(4)在一定条件下,将lmolN2和3molH2混台于一个10L的密闭容器中发生反应:
N2(g)+3H2(g) 2NH3(g)△H<0 已知5分钟后达到平衡,平衡时氨气的体积分数为25%。
2NH3(g)△H<0 已知5分钟后达到平衡,平衡时氨气的体积分数为25%。
①该反应的平衡常数表达式为:K=______________;
②能判断该反应是否达到化学平衡状态的依据是____________
a、容器中压强不变 b、混合气体的密度不变 c、3v正(H2)=2v逆(NH3) d、c(N2): c(H2): c(NH3)=1:3:2
③对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的___________
a、选用更高效的催化剂 b、升高温度 c、及时分离出氨气
d、增加H2的浓度 e、充入He,使体系总压强增大
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上12月月考化学试卷(解析版) 题型:选择题
用下列实验装置进行相应实验,装置正确且能达到实验目的是:
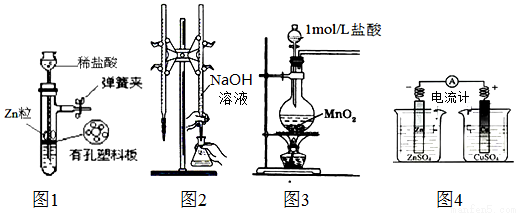
A.用图1所示装置制取少量H2
B.用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度
C.用图3所示装置制取少量Cl2
D.用图4所示装置确定导线中有电流通过并确定电流方向
查看答案和解析>>
科目:高中化学 来源:2016届浙江省金丽衢十二校高三上学期第一次联考化学试卷(解析版) 题型:选择题
下列四位同学设计的实验方案能达到实验目的的是
A.甲同学为测定0.01mol·L-1盐酸的pH值:用湿的玻璃棒蘸取盐酸,点在pH试纸上
B.乙同学要检验(NH4)2Fe(SO4)2·12H2O晶体中的NH4+:取少量晶体溶于水,加入足量浓NaOH溶液并加热,再用湿润的蓝色石蕊试纸检验产生的气体
C.丙同学为检验Fe3O4中+2价铁元素:先用稀盐酸溶解Fe3O4,再滴加KMnO4溶液
D.丁同学要验证FeCl3与KI反应的限度:可将少量的FeCl3溶液与过量的KI溶液混合,充分反应后用CCl4萃取,静置,再滴加KSCN溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上第二次月考化学试卷(解析版) 题型:选择题
一块表面己被缓慢氧化的金属钠,其质量为10.8g,投入100g水中,收集到氢气0.2g。则原来钠块表面被氧化的钠的质量是
A.6.2g B.4.6g C.7.8g D.10.6g
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上第二次月考化学试卷(解析版) 题型:填空题
现有十种物质:①铁单质 ②石墨 ③氯气 ④硫酸钡晶体 ⑤纯硫酸 ⑥盐酸 ⑦澄清石灰水 ⑧乙醇 ⑨熔化的硝酸钾 ⑩FeCl2溶液
(1)其中能导电的是 ,属于电解质的是 。
(2)请写出下列反应的离子方程式:
①与⑥反应: 。
③与⑦反应: 。
(3)H2O2能与酸性FeCl2溶液反应,请配平其化学方程式,标出电子转移的方向和数目。
HCl+ H2O2+ FeCl2= FeCl3+ H2O
其中被还原的元素是 ,氧化产物是 ,当生成9g的水时,反应转移 mol电子。
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上12月模拟化学试卷(解析版) 题型:推断题
高分子化合物G是作为锂电池中 Li+ 迁移的介质,合成G的流程如下:
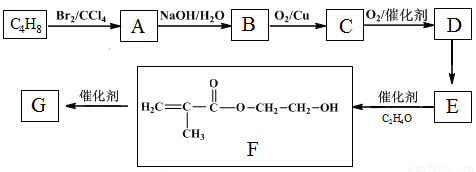
已知:①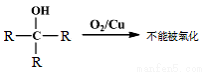
②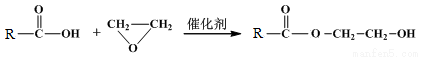
(1)A→B的反应类型是 。
(2)B→C的化学方程式是 。
(3)D的官能团名称是 。
(4)D→E反应条件是 。
(5)G的结构简式是 。
(6)D的同分异构体中,写出所有顺反异构的结构简式 。
注意:①两个羟基连在同一个碳上,羟基连在双键的碳上的结构不稳定都不予考虑。
②不考虑过氧键和环状结构 ③顺反结构均写出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com