
 (1)已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸.按要求回答下列问题:
(1)已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸.按要求回答下列问题:分析 (1)①铝和铜与合适的电解质溶液构成原电池;
②Cu、C和硫酸铁溶液构成原电池,铜易失电子发生氧化反应而作负极,碳作正极,正极上铁离子得电子发生还原反应;
③根据电解池的工作原理结合电极反应和电子守恒来计算即可;
(2)①写出氢氧燃料电池工作时正极是氧气放电,生成氢氧根离子,正极电极反应方程式:O2+2H2O+4e-=4OH-;
②消耗1mol的氧气转移,4mol电子,所以每转移0.1mol电子,消耗氧气的物质的量为:$\frac{0.1}{4}$mol=0.025mol;
③甲烷和氧气为原料进行工作时,负极甲烷发生氧化反应,碱性条件下,甲烷燃烧生成碳酸根离子.
解答 解:(1)①铜、铝的金属活泼性不同,遇到合适的电解质溶液易构成原电池,从而加快铝的腐蚀,所以不能把铜导线和铝导线连接在一起使用,
故答案为:形成原电池加速铝导线的腐蚀;
②铜、石墨的活泼性不同且都导电,铜和硫酸铁能自发的进行氧化还原反应,所以铜、石墨、硫酸铁溶液能构成原电池,铜易失去电子发生氧化反应,所以铜作负极,石墨作正极,负极上的电极反应式为:Cu-2e-=Cu2+,正极上铁离子得电子发生还原反应,电极反应式为2Fe3++2e-=2Fe2+,
故答案为:能;负极:Cu-2e-=Cu2+;正极:2Fe3++2e-=2Fe2+;
③若用石墨作电极,电解1L0.1mol/L盐酸,阳极上的反应2Cl--2e-=Cl2↑,4OH--4e-=O2↑+2H2O,阴极上的电极反应为:2H++2e-=H2↑,全部氯离子失电子总量是0.1mol生成氯气是0.05mol,失去0.4mol电子得到氧气的物质的量是0.1mol,当转移0.5mol电子时,阳极得到气体是氯气0.05mol,氧气0.1mol,所以当转移0.5mol电子时,阳极得到气体的体积(标况)为0.15mol×22.4L/mol=3.36L,故答案为:3.36;
(2)①写出氢氧燃料电池工作时正极是氧气放电,生成氢氧根离子,正极电极反应方程式:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
②消耗1mol的氧气转移,4mol电子,所以每转移0.1mol电子,消耗氧气的物质的量为:$\frac{0.1}{4}$mol=0.025mol,所以体积为:0.025mol×22.4L/mol=0.56L,故答案为:0.56L;
③甲烷和氧气为原料进行工作时,负极甲烷发生氧化反应,碱性条件下,甲烷燃烧生成碳酸根离子,其电极反应式为:CH4+10OH--8e-═CO32-+7H2O;故答案为:CH4+10OH--8e-═CO32-+7H2O.
点评 本题考查学生原电池和电解池的工作原理知识,注意知识的归纳和整理以及电池的设计原理,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心.水是组成生命体的重要化学物质,有关水的反应有很多.
2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心.水是组成生命体的重要化学物质,有关水的反应有很多. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
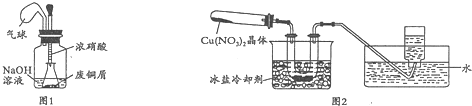
| 实验序号 | 1 | 2 | 3 | 4 |
| 温度/℃ | 35 | 50 | 70 | 95 |
| 样品颜色 | 深蓝色 | 深蓝色 | 浅绿色 | 暗蓝色 |
| 样品中碱式碳酸铜的质量分数/% | 90.9 | 92.7 | x | 92.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取碘水中的碘时,将碘水倒入分液漏斗,然后再注入酒精,震荡静置后下层液体下口出,上层液体上口出 | |
| B. | 在蔗糖溶液中加入几滴稀硫酸,水浴加热5 min,加入NaOH溶液至碱性,再加入银氨溶液并水浴加热 | |
| C. | 将Fe(NO3)2固体溶于稀硫酸后,滴加KSCN溶液,溶液变红,说明已经Fe(NO3)2变质 | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 医疗上常用75%的酒精杀菌消毒 | |
| B. | 由于分子间氢键的存在,NH3易液化,H2O常温下呈液态 | |
| C. | 雾霾公益调查纪录片《穹顶之下》的发布引起了人们的关注,雾霾属于胶体 | |
| D. | 氢气是理想的绿色能源,贮氢合金的发现和应用解决了氢气贮存运输的难题,贮氢金属与氢气发生化学反应,形成氢化物,达到贮存氢气的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
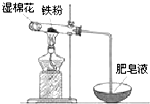 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 是否能形成丁达尔效应是胶体和溶液最本质的区别 | |
| B. | 胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 | |
| C. | “雨后彩虹”“海市蜃楼”既是一种自然现象又是光学现象,也与胶体的知识有关 | |
| D. | 除去Fe(OH)3胶体中的FeCl3,可将混合物装入半透膜中,放入蒸馏水里 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com