
【题目】A一J是中学化学中常见的物质,其相互转化关系如下图所示,反应条件均已略去。A、B常温下均为无色液体,且均由两种相同的元素组成;C、F、G均为非金属单质,常温下C、F为无色气体,G可用于制取“84”消毒液;D是应用最广泛的金属;J溶液中滴入KSCN 溶液显红色。
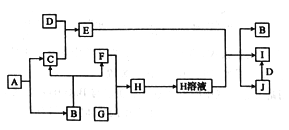
回答下列问题:
(1)A的化学式是_________,E 的俗称是_______。
(2)在空气中点燃F,然后把导管缓缓伸入盛满G的集气瓶中,观察到的实验现象是______。
(3)B和G能发生反应,写出反应的离子方程式______。
(4)G和I能发生反应,写出反应的化学方程式,并标出电子转移的方向和数目:______。
【答案】 H2O2 磁性氧化铁 氢气能在氯气中安静地燃烧,发出苍白色火焰,集气瓶口上方有白雾生成 Cl2+H2O=H++Cl-+HClO 
【解析】A、B常温下均为无色液体,且均由两种相同的元素组成,A生成B和C,C为气体,一般为H2O2生成H2O的反应,则A为H2O2,B为H2O,C为O2,G可用于制取“84”消毒液,G为Cl2,D是应用最广泛的金属,D为Fe,由转化关系可知F为H2,H为HCl,E为Fe3O4,J为FeCl3,I为FeCl2。
(1)由以上分析可知A为H2O2,E为Fe3O4,E的俗称为磁性氧化铁,故答案为:H2O2;磁性氧化铁;
(2)氢气在氯气中燃烧的实验现象为:氢气能在氯气中安静地燃烧,发出苍白色火焰,集气瓶口上方有白雾生成,故答案为:氢气能在氯气中安静地燃烧,发出苍白色火焰,集气瓶口上方有白雾生成;
(3) 氯气和水反应生成盐酸和次氯酸,次氯酸是弱酸,反应的离子方程式为Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
(4)氯气和氯化亚铁发生氧化还原反应,反应的化学方程式为2FeCl2 + Cl2 = 2FeCl3,电子转移的方向和数目可以表示为![]() 或
或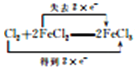 ,故答案为:
,故答案为:![]() 或
或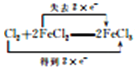 。
。


科目:高中化学 来源: 题型:
【题目】在一定温度下,某浓度的硝酸与金属锌反应生成NO2和NO的物质的量之比为1∶3,则要使1 mol金属锌完全反应,需要硝酸的物质的量为
A.2.8 mol B.2.6 mol C.2.4 mol D.0.8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①氟氯烃 ②二氧化碳 ③二氧化硫 ④废弃塑料制品 ⑤富含氮、磷元素的污水。请你根据已有的环保知识,选择恰当的序号填空:
(1)能形成酸雨的是_______; (2)能破坏臭氧层的是_________;
(3)使水体富营养化的是________;(4)导致“白色污染”的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员设计出将硫酸渣(主要成分Fe2O3,含有少量的SiO2等杂质)再利用的流程。流程中的滤液经过多次循环后用来后续制备氧化铁粉末。


(1)为了加快反应①的反应速率,可采用的措施是 。(写出一点即可)
(2)“还原”是将Fe3+转化为Fe2+。在温度T1 、T2(T1 >T2)下进行该反应,通过检测相同时间内溶液的pH,绘制pH随时间的变化曲线如右图所示。得出结论:该反应的温度不宜过高。
①通入SO2气体“还原”时, 试解释pH下降的原因是 。
②相同时间内,T1温度下溶液的pH更高的原因是 。
(3)该流程中循环使用的物质是 。
(4)为测定反应①后溶液中Fe3+的浓度以控制加入SO2的量。实验步骤为:准确量取20.00ml的反应后溶液,稀释成100mL溶液,取10.00 mL溶液,加入足量的KI晶体和2~3滴淀粉溶液,用0.50mol/L的Na2S2O3溶液与碘反应,当反应恰好完全进行时,共消耗Na2S2O3溶液20.00 mL。有关反应方程式如下:2Fe3++2I-=2Fe2++I2; 2Na2S2O3 + I2= Na2S4O6 + 2NaI
试计算原溶液中Fe3+的物质的量浓度(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的三种一元酸的钠盐NaX、NaY、NaZ溶液的pH 分别为8、9、10,则这三种一元酸的酸性由强到弱的顺序为
A. HX>HY>HZ B. HX>HZ>HY
C. HZ>HY>HX D. HY >HX>HZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,①6.72L NH3②1.204×1023个 H2S ③5.6g CH4④0.5mol HCl,下列关系正确的是( )
A.体积大小:④>③>①>②
B.原子数目:③>①>④>②
C.密度大小:④>②>③>①
D.质量大小:④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息:已知在由Na2S、Na2SO3、Na2SO4三种物质组成的混合物中,钠元素的质量分数为46%,则氧元素的质量分数的计算方法为: Na2S、Na2SO3、Na2SO4有共同的部分Na2S,可拆变合一为(Na2S)Ox,则硫元素的质量分数为
2Na﹣﹣﹣ | S |
46% | 32% |
则氧元素的质量分数为1﹣46%﹣32%=22%
由NaHS、MgSO4、NaHSO3组成的混合物中,硫元素的质量分数为32%,计算该混合物中氧元素的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数98%、密度为1.84gcm﹣3的浓硫酸配制480mL0.92molL﹣1的稀硫酸
(1)配制时,除量筒、烧杯、玻璃棒外还需玻璃仪器有、 .
(2)减小误差量取时需选用合适的量筒量取mL浓硫酸
(3)在容量瓶的使用方法中,下列操作不正确的是 .
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2cm处,改用胶头滴管加蒸馏水到标线
D.往容量瓶中转移溶液时应用玻璃棒引流
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是 . ①转移溶液时不慎有少量洒到容量瓶外面
②没有洗涤烧杯和玻璃棒
③定容时俯视刻度线
④容量瓶不干燥,含有少量蒸馏水
⑤定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线.
⑥未冷却到室温就将溶液转移到容量瓶并定容.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com