
| 第一电离能 | 电负性 | 晶格能 沸点 | |
| O <N | Cl <F | NaCl <CaO | HF >HCl |
分析 (1)钴是27号,位于周期表,第四周期VIII族;
(2)同周期从左到右第一电离能逐渐增大,第ⅡA和第Ⅴ族比相邻元素大;非金属性越强电负性越大;电离子数越多,半径越小晶格能越大;含有氢键的物质沸点较高;
(3)①铜能与浓盐酸缓慢发生置换反应,有配合物H[CuCl2]生成,所以反应方程式为2Cu+4HCl(浓)=2H[CuCl2]+H2↑;
②[Cu(H2O)4]2+中铜离子提供空轨道,氧原子提供电子对形成配位键.
解答 解:(1)钴是27号,位于周期表,第四周期VIII族,故答案为:四;VIII;
(2)同周期从左到右第一电离能逐渐增大,第ⅡA和第Ⅴ族比相邻元素大,所以O第一电离能小于N第一电离能;非金属性F大于Cl,所以电负性F大于Cl;电离子数越多,半径越小晶格能越大,所以氯化钠的晶格能小于氧化钙;氟化氢分子间存在氢键,所以沸点HF大于HCl,
故答案为:<;<;<;>;
(3)①铜能与浓盐酸缓慢发生置换反应,有配合物H[CuCl2]生成,所以反应方程式为:2Cu+4HCl(浓)=2H[CuCl2]+H2↑,
故答案为:2Cu+4HCl(浓)=2H[CuCl2]+H2↑;
②[Cu(H2O)4]2+中铜离子提供空轨道,氧原子提供电子对形成配位键,所以[Cu(H2O)4]2+的结构可用示意图表示为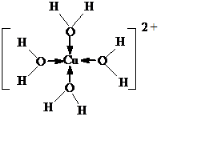 ,那么1mol该物质中含有σ键数目为8+4=12mol,故答案为:12NA.
,那么1mol该物质中含有σ键数目为8+4=12mol,故答案为:12NA.
点评 本题考查了化学反应的能量变化与第一电离能、电负性、晶格能、沸点以及化学方程式的书写,综合性强,但比较基础.


科目:高中化学 来源: 题型:选择题
| A. | 加热时有无气体放出 | |
| B. | 滴加盐酸时有无气泡放出 | |
| C. | 溶于水后,滴加氯化钙溶液有无白色沉淀生成 | |
| D. | 溶于水后,滴加澄清石灰水,有无白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图表示反应N2(g)+3H2(g)2NH2(g)△H<0.在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )
如图表示反应N2(g)+3H2(g)2NH2(g)△H<0.在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )| A. | t5~t6 | B. | t2~t3 | C. | t3~t4 | D. | t0~t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO${\;}_{3}^{2-}$ | B. | HCO${\;}_{3}^{-}$ | C. | CH3COO- | D. | SO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下硝酸铵溶于水是一个能自发进行的吸热过程,说明该过程的△S>0 | |
| B. | 反应 A(g)+3B(g)?2C(g)达平衡后,升高温度,平衡常数增大,则正反应的△H<0 | |
| C. | 已知H+(aq)+OH- (aq)=H2O(l);△H=-57.3 kJ/mol.将4 g氢氧化钠固体放入100 mL 1 mol/L的稀盐酸中,放出了5.73 kJ的热量 | |
| D. | 检验C2H5Cl中的氯元素:先将C2H5Cl与NaOH溶液混合后加热,冷却后再AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
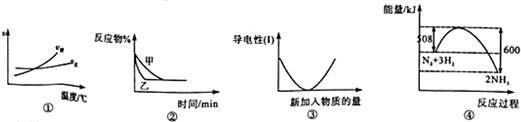
| A. | 根据图①可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H>0 | |
| B. | 图②可以表示压强对可逆反应“2A(g)+2B(g)?3C(g)+D(s)”的影响,乙的压强大 | |
| C. | 图③可表示硫酸溶液中滴加氢氧化钡溶液至过量过程中溶液导电性的变化 | |
| D. | 图④是N2与H2合成氨的能量变化曲线,可确定该反应,1molN2和3molH2充分反应时放热一定等于92kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN碳原子为sp杂化,分子为直线型 | |
| B. | CO2分子中碳原子为sp2杂化,分子为V型 | |
| C. | CH2=CH2分子中碳原子为sp3杂化,分子为三角型 | |
| D. | 乙炔分子中碳原子为sp2杂化,分子为直线型 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a | B. | b | C. | c | D. | d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com