
【题目】某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行实验并得到下表实验结果:
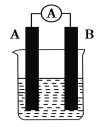
实验序号 | A | B | 烧杯中的液体 | 灵敏电流表指针是否偏转 |
1 | Zn | Zn | 乙醇 | 无 |
2 | Zn | Cu | 稀硫酸 | 有 |
3 | Zn | Cu | 稀硫酸 | 无 |
4 | Zn | Cu | 苯 | 无 |
5 | Cu | C | 氯化钠溶液 | 有 |
6 | Mg | Al | 氢氧化钠溶液 | 有 |
分析上述实验,回答下列问题:
(1)实验2中电流由________极流向________极(填“A”或“B”)。
(2)实验6中电子由B极流向A极,表明负极是________(填“镁”或“铝”)电极。
(3)实验5表明________(填字母序号,下同)。
A.铜在潮湿空气中不会被腐蚀
B.铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是________。
A.金属活动顺序表中,活泼性强的金属一定作负极
B.失去电子的电极是负极
C.烧杯中的液体必须是电解质溶液
D.原电池中,浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属)
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】烯烃A在一定条件下可以按下图进行反应 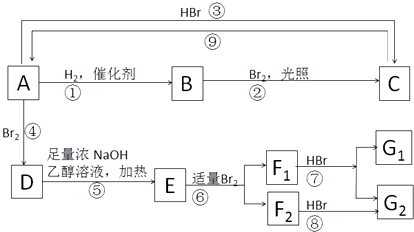
已知:1molA完全燃烧可生成6mol CO2和6mol H2O,仪器分析显示它有四个完全对称的甲基.F1和F2互为同分异构体,G1和G2互为同分异构体.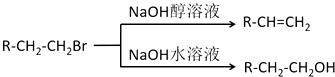
(1)A的名称为
(2)D的结构简式为; G2的结构简式为
(3)反应②的反应类型为;反应⑨的反应类型为 , 反应条件是
(4)请写出反应⑤的化学方程式:;请写出E→F1的化学方程式:
(5)A的烯烃同分异构体有种(不考虑顺反异构)
(6)烯烃是有机合成中重要的原料,图是一种由烯烃合成的有机物S的红外光谱图,有机物S的红外光谱图如下: 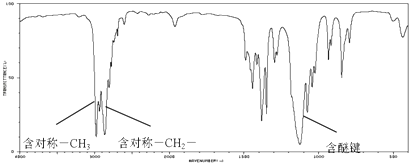
符合该条件的S相对分子质量最小的结构简式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列的有机物合成路线回答问题: 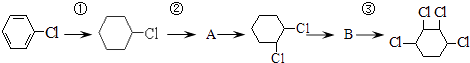
(1)写出A、B的结构简式:A、B .
(2)写出各步反应类型:①②③ .
(3)写出②、③的反应方程式: ② ,
③ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】获得“863”计划和中科院“百人计划”支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,相关论文发表在J.Am.Chem.Soc.(128,8720~8721,2006)上,已知电池总反应式为2Al+3I2═2AlI3 . 下列说法不正确的是( )
A.该电池负极的电极反应为:Al﹣3e﹣═Al3+
B.该电池可能是一种可充电的二次电池
C.消耗相同质量金属时,用锂作负极产生电子的物质的量比用铝时多
D.电池工作时,溶液中铝离子向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宋代著名法医学家宋慈的《洗冤集录》中有银针验毒的记载,“银针验毒”涉及的化学反应是 4Ag+2H2S+O2→2X+2H2O,下列说法正确的是
A.X的化学式为AgSB.银针验毒时,空气中氧气失去电子
C.反应中Ag和H2S均是还原剂D.每生成1mo1X,反应转移2mo1 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0.20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为 , 表中bc(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为 mol/L,0~20s内N2O4的平均反应速率为 .
(3)该反应的平衡常数表达式K= , 在80℃时该反应的平衡常数K值为(保留2位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 .
A.N2O4的转化率越高
B.NO2的产量越大
C.N2O4与NO2的浓度之比越大
D.正反应进行的程度越大.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com