
【题目】有色金属行业发展蕴藏着巨大潜力。目前,全世界消费量排在前五位为铜、铝、铅、锌、镍。
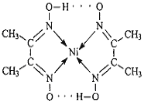
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于___晶体;基态Ni原子的价电子电子排布式为____。
(2)铜原子的电子占有____种能量不同的原子轨道。
(3)配合物分子内(如图)的作用力有_____(填编号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如 ①CH2=CH2、②CH≡CH、③![]() 、④HCHO等,其中分子中C原子为SP2杂化的有____(填物质序号),预测HCHO分子的立体结构为_____形。
、④HCHO等,其中分子中C原子为SP2杂化的有____(填物质序号),预测HCHO分子的立体结构为_____形。
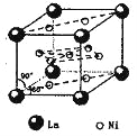
(5)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为______。
(6)邻羟基苯甲醛的沸点____(填大于,小于或等于)对羟基苯甲醛的沸点。
【答案】分子 3d84s2 7 ACE ①③④ 平面三角 LaNi5 小于
【解析】
(1)熔沸点低的晶胞为分子晶体;Ni核电荷数为28,根据构造原理写出价电子排布式;
(2)写出Cu基态原子的电子排布式,找出有多少种能级,每个能级就是能量不同的原子轨道;
(3)观察题目给出的结构式分析作用力,虚线一般为氢键;
(4)碳原子采取sp2杂化的物质的结构为平面型;采取sp3杂化的物质的结构为四面体;采取sp杂化的物质的结构为直线型;
(5)根据均摊法求算晶胞中微粒个数:顶点占1/8,面占1/2,棱占1/4;
(6)分子内氢键降低物质熔沸点,分子间氢键增大物质熔沸点。
(1)因为Ni(CO)4常温时为液态,易溶于CCl4,所以固态Ni(CO)4属于分子晶
体,基态Ni原子的电子排布式为1s22s22p63s23p63d84s2,价电子电子排布式为3d84s2;答案:分子;3d84s2;
(2)Cu基态原子的电子排布式1s22s22p63s23p63d104s1,1s、2s、2p、3s、3p、3d、4s能级能量不同,故有7种能量不同的原子轨道;答案:7;
(3)由结构式知该配合物含氢键、配位键、共价键;答案:ACE;
(4)碳原子采取sp2杂化的物质的结构为平面型;采取sp3杂化的物质的结构为四面体;采取sp杂化的物质的结构为直线型,则采取sp2杂化的有①③④,HCHO中C原子为sp2杂化,且C原子无孤电子对,则分子的立体结构为平面三角形;答案:①③④;平面三角;
(5)根据晶胞中微粒个数求算方法:顶点占1/8,面占1/2,棱占1/4,则镧(La)和镍(Ni)个数分别为8x1/8=1、8x1/2+1=5,该晶体的化学式为LaNi5;答案:LaNi5;
(6)由于邻羟基苯甲醛形成分子内氢键,而对羟基苯甲醛能够形成分子间氢键,分子内氢键降低物质熔沸点,分子间氢键增大物质熔沸点,所以邻羟基苯甲醛比对羟基苯甲醛熔、沸点低;答案:小于。


科目:高中化学 来源: 题型:
【题目】一定条件下,将3 mol A和1 mol B两种气体混合于容积为2L的密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g)+ 2D(g)。2 min末该反应达到平衡,生成1.0 mol D,并测得C的浓度为0.25 mol/L。下列判断错误的是( )
xC(g)+ 2D(g)。2 min末该反应达到平衡,生成1.0 mol D,并测得C的浓度为0.25 mol/L。下列判断错误的是( )
A. 平衡常数约为0.25
B. B的转化率为50%
C. A的平均反应速率为0.25 mol/( L·min)
D. 若反应前后压强之比为4:3则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和镁的合金4.6 g完全溶于浓硝酸,若反应中硝酸被还原只产生4 480 mL NO2气体和336 mL的N2O4气体(气体的体积已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为 ( )
A.9.02 gB.8.51 gC.8.26 gD.7.04 g
查看答案和解析>>
科目:高中化学 来源: 题型:
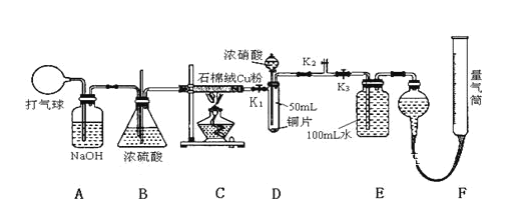
【题目】某化学兴趣小组欲验证:“铜和一定量的浓硝酸反应有一氧化氮产生”。设计使用了如图装置进行实验。(假设气体体积均为标准状况,导气管中气体体积忽略不计,且忽略反应中的溶液体积变化)
试回答下列问题:
(1)在铜和浓硝酸反应前,挤压打气球(球内充满空气),经A、B、C反应后,气体进入D中,通入该气体的目的是_______;进行此步操作时应关闭_______,打开_____(填K1、K2或K3,上同)。
(2)关闭K1、K2,打开K3,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入CCl4至满。则D中一定发生反应的离子方程式为:___。
(3)若E装置中出现倒吸,可采取的应急操作是____________;
(4)若测得反应后E装置中HNO3的浓度为0.072mol/L,F装置所收集到的气体体积为139.00 mL,则铜和一定量的浓硝酸反应___(填“有”或“无”)NO生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体A的产量可以用来衡量一个国家石油化工发展水平。下图是由A为原料生产B的转化关系图,B是一种有香味的液体。

(1)将A通入溴水中,观察到的实验现象是__________,A分子中的官能团是______。
(2)写出CH3CH2OH与CH3COOH反应生成B的化学方程式_____________________。
(3)写出乙醇的一种用途____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出表示含有8个质子,10个中子的原子的化学符号:__________。
(2)根据下列微粒回答问题:![]() 、
、![]() 、
、![]() 、14C、14N、16O、35Cl2、37Cl2。
、14C、14N、16O、35Cl2、37Cl2。
①以上8种微粒共有________种核素,共_________种元素。
②互为同位素的是________________。
③质量数相等的是_________和_________,中子数相等的是_______和_________。
(3)相同物质的量的14CO2与S18O2的质量之比为_________;中子数之比为_______;电子数之比为________。
(4)铷和另一种碱金属形成的合金7.8 g与足量的水反应后,产生0.2 g氢气,则此合金中另一碱金属可能是:________________。(铷的相对原子量取85.5)
(5)质量相同的H2O和D2O与足量钠反应,放出的气体在标况下的体积之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素的性质或原子结构 |
T | M层上的电子数是其原子核外电子层数的2倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下,单质为双原子分子,其氢化物的水溶液呈碱性 |
Z | 元素的最高正化合价是+7 |
(1)元素T在元素周期表中的位置是第________周期第________族。
(2)元素X的一种同位素可测定文物的年代,这种同位素的符号是________。
(3)元素Y与氢元素形成一种分子YH3,该分子的化学式为____________________。
(4)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下,Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下,Z和T的单质都能与NaOH溶液反应
(5)T、X、Z三种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序是______________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的铁和铜的混合物24g 与600mL稀硝酸恰好完全反应,生成NO 6.72L(标准状况),向反应后的溶液中加入1mol·L—1 NaOH溶液使金属离子恰好沉淀,过滤。下列有关说法错误的是( )
A. 混合物溶解后的溶液中c(Fe3+):c(Fe2+)=1:1 B. 稀硝酸的物质的量浓度是2 mol·L—1
C. 需加入NaOH溶液1000mL D. 最后所得沉淀在空气中充分加热可得固体32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油裂解得到的乙烯和 1,3-丁二烯为原料,经过下列反应合成高分子化合物 H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。

请按要求填空:
(1)写出下列反应的反应类型:反应①____________ ,反应⑤ _______________,反应⑧_____________________
(2)反应②的化学方程式是 ____________________
(3) 反应③、④中有一反应是与 HCl 加成,该反应是__________(填反应编号),设计这一步反应的目的是_______________________,物质 C 的结构简式是____________________ 。
(4)反应⑨的化学方程式是 _______________
(5)写出与 G 具有相同种类和数目的官能团的同分异构体:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com