
| A.①②③ | B.①③④ | C.②③⑤ | D.②④⑤ |
科目:高中化学 来源:不详 题型:单选题
| 编号 | 实验内容 | 实验目的 |
| A | 将含有HCl杂质的CO2通入饱和Na2CO3溶液中 | 除去CO2中的HCl |
| B | 将适量一定量的NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤 | 分离出NaCl晶体 |
| C | 在淀粉-KI溶液中滴加少量市售食盐配制的溶液 | 鉴别真假碘盐 |
| D | 将少量Fe(NO3)2试样加水溶解,滴加稀H2SO4酸化,再滴加KSCN溶液 | 检验Fe(NO3)2试样是否变质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ba(OH)2 | B.H2SO4 | C.NaOH | D.AgNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
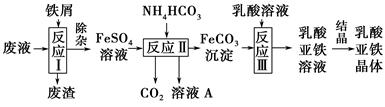
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
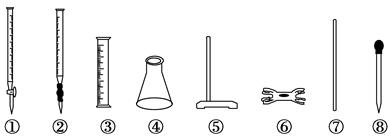
| A.①④⑤⑥ | B.②③⑦⑧ | C.②④⑤⑥ | D.④⑤⑥⑧ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
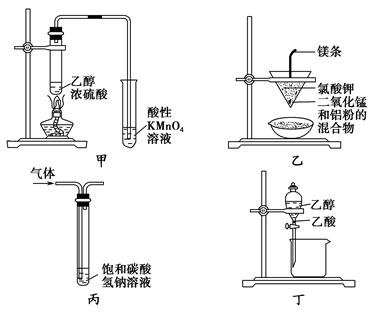
| A.甲图所示装置可以检验有乙烯生成 |
| B.乙图所示装置可以制取金属锰 |
| C.丙图所示装置用来洗气,除去CO2中的HCl气体 |
| D.丁图所示装置用来分离乙醇和乙酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
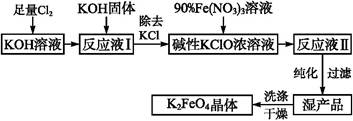
 KCl+KClO+H2O(条件:温度较低)
KCl+KClO+H2O(条件:温度较低) 5KCl+KClO3+3H2O(条件:温度较高)
5KCl+KClO3+3H2O(条件:温度较高) 2K2FeO4+6KNO3+3KCl+5H2O
2K2FeO4+6KNO3+3KCl+5H2O ;② 。
;② 。 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.此法的优点之一是原料来源丰富 |
| B.该提取镁的过程中涉及置换、分解、复分解和氧化还原反应 |
| C.步骤①②③的目的是从海水中提取无水MgCl2 |
| D.步骤②中加盐酸的离子方程式为Mg(OH)2+2H+=Mg2++2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com