
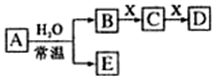
 A、B、C、D、E、X均为中学化学常见物质,其中A、B、C、D、E是由短周期元素组成的无机物,它们存在如图转化关系(部分生成物和反应条件略去).请回答下列问题:
A、B、C、D、E、X均为中学化学常见物质,其中A、B、C、D、E是由短周期元素组成的无机物,它们存在如图转化关系(部分生成物和反应条件略去).请回答下列问题: ; B与X反应生成C的离子方程式2OH-+CO2=CO32-+H2O;
; B与X反应生成C的离子方程式2OH-+CO2=CO32-+H2O;分析 I.(1)X是一种温室效应气体,应为CO2,可知A为Na,B为NaOH,由转化关系可知C为Na2CO3,D为NaHCO3,E为H2;
(2)D为白色胶状沉淀,应为Al(OH)3,A可为Cl2,B为HCl,E为HClO等,X为NaAlO2,C为AlCl3;
II.(3)当A与H2O反应为氧化还原反应时,且氧化剂与还原剂物质的量之比为1:2,可NO2为与水的反应,A为NO2,E为NO,B为HNO3,C为Fe(NO3)3,D为Fe(NO3)2;
(4)A中的阳离子是其所在周期中简单离子半径最小的,阳离子应为Al,A与H2O的反应为非氧化还原反应时,且A中阴、阳离子分别为18电子与10电子粒子,则A为Al2S3,与水反应生成氢氧化铝和硫化氢.
解答 解:(1)X为二氧化碳,电子式为 ,B为NaOH,C为Na2CO3,B与X反应生成C的离子方程式为2OH-+CO2=CO32-+H2O,
,B为NaOH,C为Na2CO3,B与X反应生成C的离子方程式为2OH-+CO2=CO32-+H2O,
故答案为: ;2OH-+CO2=CO32-+H2O;
;2OH-+CO2=CO32-+H2O;
(2)E为HClO,具有强氧化性,可用于漂白剂或杀菌消毒,B为HCl,X为NaAlO2,C为AlCl3,B与X反应生成C的离子方程式为AlO2-+4H+=Al3++2H2O,
故答案为:漂白剂或杀菌消毒;AlO2-+4H+=Al3++2H2O;
(3)D为Fe(NO3)2,加入氢氧化钠生成不稳定的氢氧化亚铁,易被氧化生成氢氧化铁,现象是生成白色沉淀迅速转化为灰绿色最后变为红褐色,
故答案为:生成白色沉淀迅速转化为灰绿色最后变为红褐色;
(4)A为Al2S3,与水反应生成氢氧化铝和硫化氢,方程式为Al2S3+6H2O=2Al(OH)3+3H2S↑,故答案为:Al2S3+6H2O=2Al(OH)3+3H2S↑.
点评 本题考查无机物的推断,是高考中的常见题型,试题综合性强,难度较大,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生分析问题、以及灵活运用基础知识解决实际问题的能力.做好本题的关键之处在于把握好常见物质的性质以及有关转化,并能结合题意具体问题、具体分析即可.


科目:高中化学 来源: 题型:实验题
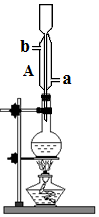 将无水乙醇、冰醋酸、浓硫酸放入烧瓶中,并加入沸石,加热一段时后,再更换装置可蒸馏出乙酸乙酯.
将无水乙醇、冰醋酸、浓硫酸放入烧瓶中,并加入沸石,加热一段时后,再更换装置可蒸馏出乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甘油用作护肤保湿剂 | |
| B. | 高锰酸钾溶液用于水果保鲜 | |
| C. | 铁粉用作食品袋中的脱氧剂 | |
| D. | 浓盐酸用于检验输送氨气管道是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
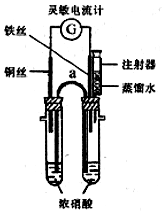 某化学课外活动小组的同学利用原电池原理探究一定温度下(实验时实际的环境温度)使铁钝化的硝酸的最低浓度.
某化学课外活动小组的同学利用原电池原理探究一定温度下(实验时实际的环境温度)使铁钝化的硝酸的最低浓度.| 实验次数 | 实验温度(℃) | 注入水的体积(mL) |
| 1 | 17.2 | 2.4 |
| 2 | T1 | 2.5 |
| 3 | T2 | 2.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com