
 化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑.请根据你所学知识回答:
化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑.请根据你所学知识回答:分析 (1)镍是28号元素,原子核外有28个电子,根据构造原理书写基态镍原子的核外电子排布式的简化形式;
(2)根据熔沸点判断晶体类型;原子数总数相同、电子数目相同的微粒,互称为等电子体;
(3)氯化铵是离子化合物,由氨根离子与氯离子构成;N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子;
(4)①同一周期元素的第一电离能随着原子序数的增大而增大,但第VA族元素第一电离能大于第VIA元素;
②根据价层电子对互斥理论确定其空间构型;
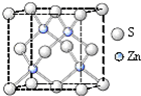
③根据图片确定其配位数;根据均摊法计算一个晶胞中含有的原子数目,根据晶胞密度$ρ=\frac{m}{V}$计算.
解答 解:(1)镍是28号元素,原子核外有28个电子,根据构造原理基态镍原子的核外电子排布式为[Ar]3d84s2,外围电子排布式为3d84s2,故答案为:3d84s2;
(2)四碳基镍熔沸点较低,为分子晶体,CO与N2分子中都含有2个原子,电子总数分别为14、14,互为等电子体,答案为:分子晶体;N2;
(3)氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ,含有离子键和共价键(配位键);
,含有离子键和共价键(配位键);
N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子;
故答案为:离子键、共价键(配位键);F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子;
(4)①同一周期中,第VA族元素第一电离能大于第VIA元素,As 和Se属于同一周期,As是第VA元素,Se是第VIA元素,所以第一电离能As>Se,故答案为:>;
②二氧化硒分子中价电子对个数=2+$\frac{1}{2}$(6-2×2)=3,含有一个孤电子对,所以其空间构型是V形,故答案为:V形;
③根据图片知,每个Zn离子连接4个S离子,所以其配位数是4;
晶胞中Zn原子数目为4,S原子数目为$8×\frac{1}{8}+6×\frac{1}{2}=4$,晶胞体积V=(a×10-10)3,晶胞密度$ρ=\frac{m}{V}$=$\frac{\frac{(65+32)×4}{{N}_{A}}}{(a×1{0}^{-10})^{3}}$,NA=$\frac{3.88×1{0}^{32}}{ρ{a}^{3}}$,
故答案为:4;$\frac{3.88×1{0}^{32}}{ρ{a}^{3}}$.
点评 本题考查了分子构型判断、核外电子排布式的书写、等电子体应用、晶胞计算,其中电子排布式、分子构型判断是高考的热点,是学习的重点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| Ⅰ | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| Ⅱ | 800 | c1 | c2 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与Z同族的第五周期元素的原子序数为50 | |
| B. | Y的简单氢化物的沸点和热稳定性均大于R的简单氢化物 | |
| C. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2,且均能与水反应 | |
| D. | 由W和Z组成的ZW物质硬度大、熔沸点高,具有导磁性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁溶于稀硝酸,溶液变为浅绿色Fe+4H++NO3 --=Fe3++NO↑+2H2O | |
| B. | 向K2Cr2O7溶液中加少量浓硫酸,溶液变为黄色Cr2O7 2-(橙色)+H2O?2CrO4 2-(黄色)+2H+ | |
| C. | 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝4H++4I-+O2=2I2+2H2O | |
| D. | 稀的氨水溶液吸收了少量的二氧化碳气体NH3•H2O+CO2=NH4++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
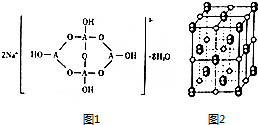 已知A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大.其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子.D、E为同周期元素且分别位于s区和d区.五种元素所有的s能级电子均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和.回答下列问题:
已知A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大.其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子.D、E为同周期元素且分别位于s区和d区.五种元素所有的s能级电子均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和.回答下列问题: .
.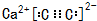 ,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为2.28g/cm3(保留到小数点后两位).
,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为2.28g/cm3(保留到小数点后两位).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com