
【题目】某同学想通过利用如图所示装置(夹持装置略去)实验,探究SO2与Na2O2反应的产物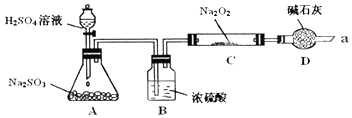
(1)请分析:
Ⅰ.装置B的作用装置D的作用
Ⅱ.对C中固体产物提出如下假设:假设1:只有Na2SO3 假设2:只有Na2SO4假设3:
若按假设2进行,反应方程式为
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲同学设计如下实验:得出结论:假设2成立
C中的固体配成溶液 ![]() 白色沉淀
白色沉淀 ![]() 沉淀不溶解
沉淀不溶解
该方案是否合理(填“是”或“否”),理由是
(3)若假设2成立,反应前后C管增加6.4g,请计算10g含有杂质的Na2O2固体中,Na2O2的质量分数为(所含的杂质不与SO2发生反应)
【答案】
(1)干燥SO2气体,防止水蒸气与Na2O2反应,防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应,同时吸收过量的SO2,以免污染空气,有Na2SO3和Na2SO4,Na2O2+SO2=Na2SO4
(2)否,HNO3有氧化性,据此不能确定产物是Na2SO3还是Na2SO4或二者兼有
(3)78%
【解析】解:Ⅰ、浓硫酸有吸水性,能吸收二氧化硫中的水分,防止水蒸气与过氧化钠反应而干扰二氧化硫;碱石灰是干燥剂,能吸收水分,防止水蒸气的干扰,碱石灰是碱性物质,能吸收二氧化硫等酸性气体,防止污染大气,
故答案为:干燥SO2气体,防止水蒸气与Na2O2反应;防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应,同时吸收过量的SO2,以免污染空气;
Ⅱ、推理法可以推出:假设3:是含有亚硫酸钠和硫酸钠的混合物,
故答案为:有Na2SO3和Na2SO4;
(1)过氧化钠和二氧化硫反应生成硫酸钠的原理方程式为:Na2O2+SO2=Na2SO4,
故答案为:Na2O2+SO2=Na2SO4;
(2)生成的白色沉淀中如果含有亚硫酸钡,加入硝酸后,会将之氧化为硫酸钡,不能得出结论:产物是Na2SO4,
故答案为:否;HNO3有氧化性,据此不能确定产物是Na2SO3还是Na2SO4或二者兼有;
(3)若假设2成立,过氧化钠和二氧化硫的反应为:Na2O2+SO2=Na2SO4,则反应前后C管增加6.4g即参加反应的SO2质量,则参加反应的Na2O2物质的质量m(Na2O2)= ![]() ×78g/mol=7.8g,所以Na2O2的质量分数为
×78g/mol=7.8g,所以Na2O2的质量分数为 ![]() ×100%=78%;
×100%=78%;
故答案为:78%.
Ⅰ、根据浓硫酸的吸水性以及二氧化硫、过氧化钠的性质来回答;
Ⅱ、推理法可以推出:假设3:是含有亚硫酸钠和硫酸钠的混合物;
(1)过氧化钠和二氧化硫反应生成硫酸钠;
(2)硝酸具有氧化性,能将亚硫酸钡氧化为不溶于硝酸的硫酸钡;
(3)根据反应前后C管增加6.4g即参加反应的SO2质量来计算Na2O2质量,再计算质量即可.


科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl﹣、CO32﹣、SO42﹣ , 现取两份100mL溶液进行如下实验: ①第一份加过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,同时得到溶液甲.
②在甲溶液中通入过量CO2 , 生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g.
③第二份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g.
根据上述实验回答:
(1)一定不存在的离子是 , 不能确定是否存在的离子是 .
(2)试确定溶液中肯定存在的离子及其浓度(可不填满): 离子符号 , 浓度;
离子符号 , 浓度;
离子符号 , 浓度 .
(3)试确定K+是否存在(填“是”或“否”),判断的理由是 .
(4)设计简单实验验证原溶液中可能存在的离子 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们为保证身体健康,生病时需要服药,但药品通常既有治疗作用,又有副作用。据此回答:
(1)工业上制备阿司匹林的反应方程式为。
(2)麻黄碱是一种治疗支气管哮喘的中草药,但具有副作用,属于剂。
(3)抗酸药是治疗胃酸过多的一类药品,请写出以下两种抗酸药中和胃酸反应的离子方程式。
①Al(OH)3:。
②NaHCO3:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积): 
下列说法正确的是( )
A.固体混合物中一定含有Al,但质量不可确定
B.固体混合物中可能含有MgCl2和AlCl3
C.固体混合物中一定含有MgCl2和FeCl2
D.固体混合物中一定含有(NH4)2SO4、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质的性质比较正确的是
A. 酸性:H2SiO3 > H3PO4B. 氧化性:Cl2 > F2
C. 稳定性:H2S > HFD. 碱性:NaOH > Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有浓度为0.1molL﹣1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+) 依次为a molL﹣1 , b molL﹣1 , c molL﹣1 , 其大小顺序为 .
(2)等体积的以上三种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量依次为n 1mol,n2 mol,n3 mol,它们的大小关系为
(3)中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为
(4)与锌反应时产生氢(气)的速率分别为v1、v2、v3 , 其大小关系为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8(过二硫酸铵)溶液会发生如下反应:Mn2++S2O82﹣+H2O→MnO4﹣+SO42﹣+H+ , 下列说法不正确的是( )
A.可以利用该反应检验Mn2+
B.氧气性比较:S2O82﹣>MnO4﹣
C.该反应中酸性介质可以为盐酸
D.若有0.1mol氧化产物生成,则转移电子0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ag2CrO4在水中的沉淀溶解平衡曲线如图所示,t℃时,反应Ag2CrO4(s)+2Cl﹣(aq)=2AgCl(s)+CrO42﹣(aq)的K=2.5×107 , 下列说法正确的是( )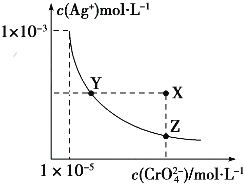
A.t℃时,Ag2CrO4的Ksp为1×10﹣12
B.t℃时,向饱和Ag2CrO4溶液中加入K2CrO4溶液,再次平衡时c2(Ag+)×c(CrO42﹣)>Ksp
C.t℃时,Ksp(AgCl)=1.56×10﹣10
D.t℃时,用0.01molL﹣1 AgNO3溶液滴定20mL 0.01molL﹣1KCl和0.01mol K2CrO4的混合溶液,CrO42﹣先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁是中学化学实验室中常用的化学试剂.同学们利用废铁屑(含少量铜杂质)来探究制备FeCl36H2O的方法,同学甲设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有足量的稀硝酸,实验时先打开a并关闭b,用分液漏斗向A中加入过量的盐酸充分反应,此时溶液呈浅绿色;再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl36H2O晶体. 填写下列空白:
(1)滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是 .
(2)烧杯内放过量稀HNO3的原因是(用离子方程式表示).
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是 .
(4)乙同学对该实验进行了改进,他是用空烧杯盛接滤液,加入适当的试剂,然后在HC1的气流中、一定温度下蒸发、浓缩、降温结晶而得到纯净的FeCl36H2O,你认为加入的试剂可以是 . (填序号) ①适量氯气 ②适量过氧化氢和稀盐酸
③酸性高锰酸钾溶液 ④氢氧化钠溶液.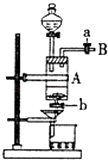
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com