
| A. | ②⑦ | B. | ②⑤⑦ | C. | ①③④ | D. | ②⑤⑥⑦ |
分析 可逆反应A(气)+3B(气)?2C(气)+2D(固)达到平衡状态,一定满足正逆反应速率相等,反应体系中各组分的浓度不再变化;注意生成物D是固体,反应两边气体的质量不相等,据此进行判断.
解答 解:①C的生成速率与C的分解速率相等,说明正逆反应速率相等,该反应达到了化学平衡状态,故①不选;
②单位时间内生成amolA,同时生成3amolB,表示的都是逆反应速率,无法判断正逆反应速率是否相等,无法判断是否达到了平衡状态,故②选;
③A、B、C的浓度不再变化,说明正逆反应速率相等,反应达到了平衡状态,故③不选;
④A、B、C的分压强不再变化,反应方程式两边气体的体积不相等,压强不变,说明正逆反应速率相等,达到了平衡状态,故④不选;
⑤混合气体的总压强不再变化,反应方程式两边气体的化学计量数之和不相等,总压强不再变化,说明各组分的浓度不变,正逆反应速率相等,达到了平衡状态,故⑤不选;
⑥反应两边气体的体积不相同,混合气体的物质的量是个变化的量,混合气体的物质的量不再变化,说明正逆反应速率相等,达到了平衡状态,故⑥不选;
⑦单位时间内消耗amolA,同时生成 3amolB,说明正逆反应速率相等,各组分的浓度不再变化,达到了平衡状态,故⑦不选;
⑧A、B、C、D的分子数之比为1:3:2:2,不能判断各组分的分子数是否不再变化,无法判断是否达到平衡状态,故⑧选;
故选:A.
点评 本题考查了化学平衡状态的判断,题目难度不大,注意反应达到平衡状态时,一定满足正逆反应速率相等、各组分的浓度不再变化.


科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L的NaHS溶液中HS-和S2-离子数之和为0.1NA | |
| B. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| C. | 1 mol Na2O2固体中含离子总数为4NA | |
| D. | 3 mol Fe在足量的水蒸气中完全反应转移9NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 活性炭/mol | NO/mol | A/mol | B/mol | P/MPa | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.250 | P |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO | B. | NH3 | C. | H2O2 | D. | CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | 实验原理 | |
| A | 提纯混有少量硝酸钾的氯化钠 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升高显著增大 |
| B | 配制FeCl3溶液 | 将FeCl3固体溶解于适量硫酸溶液 | H+抑制FeCl3水解 |
| C | 检验溶液中是否含有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | NH3溶于水后溶质的主要存在形式是NH4+、OH- |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡 | 3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
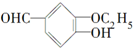 ,下列对该物质叙述正确的是( )
,下列对该物质叙述正确的是( )| A. | 该物质可以进行消去反应 | |
| B. | 该物质可以进行水解反应 | |
| C. | 1 mol该物质最多可与3 mol H2反应 | |
| D. | 该物质可以和Br2进行取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水,S${O}_{3}^{2-}$浓度增大 | |
| B. | 通入少量Cl2气体,溶液pH增大 | |
| C. | 加少量CaSO3粉末,HS${O}_{3}^{-}$ 浓度基本不变 | |
| D. | 通入少量HCl气体,溶液中HS${O}_{3}^{-}$ 浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气、酒精和汽油分别属于化石能源、可再生能源和二次能源 | |
| B. | 富含N、P元素的生活用水可以直接用来灌溉农田 | |
| C. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| D. | 我国油品从国 IV 汽油升级到国 V 汽油,有助于减少酸雨、雾霾,提高空气质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com