
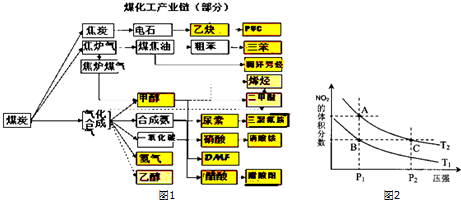
| c(H2)c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式| c 2(CO) |
| c(CO 2) |
| c(H 2)×c(CO 2) |
| c(CO)×c(H 2O) |
| c(CO)×c(H 2) |
| c(H 2O) |
| c×c |
| (0.02-c)×(0.02-c) |
| 0.015mol/L |
| 0.02mol/L |
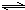 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.则
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.则

科目:高中化学 来源: 题型:
| A、2.4g金属镁所含电子数目为0.2NA |
| B、1摩尔CH4所含质子数目为10NA |
| C、标准状况下22.4LH2O所含分子数目为NA |
| D、18gNH4+所含电子数目为10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
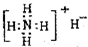



18 8 |
| A、②③⑥ | B、①③⑤⑥ |
| C、③⑥ | D、①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定温度下,弱酸的电离常数越大,酸性越强 |
| B、醋酸的电离常数K.和醋酸钠的水解常数之间的关系为:Ka?Kh=Kw |
| C、平衡常数只受温度影响,与反应物或生成物的浓度变化无关 |
| D、合成氨的反应,正反应的平衡常数和逆反应的平衡常数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
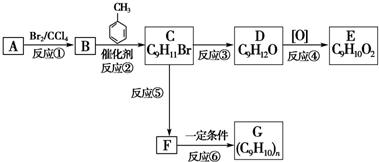
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com