
| A�� | 1 L 0.5 mol•L-1��Fe2��SO4��3 ��Һ��Fe3+����ĿΪNA | |
| B�� | �����£�pH=13��NaOH��Һ�У�OH-������ĿΪ0.1NA | |
| C�� | 0.1 L 0.5 mol•L-1 CH3COOH��Һ�к��е���������ĿС��0.05NA | |
| D�� | ��⾫��ͭʱ���������õ�������Ϊ2NA������������������64 g |
���� A������������Ϊ���������ӣ�ˮ��Һ�в���ˮ�⣻
B����Һ���δ֪��
C������Ϊ������ʣ����ֵ��룻
D����⾫��ͭʱ���������Ǵ�ͭ����ͭ���������������ʣ�
��� �⣺A������������Ϊ���������ӣ�ˮ��Һ�в���ˮ�⣬����1 L 0.5 mol•L-1��Fe2��SO4��3 ��Һ��Fe3+����ĿС��NA����A����
B����Һ���δ֪�����������������Ӹ�������B����
C������Ϊ������ʣ����ֵ��룬����0.1 L 0.5 mol•L-1 CH3COOH��Һ�к��е���������ĿС��0.05NA����C��ȷ��
D����⾫��ͭʱ���������Ǵ�ͭ����ͭ����������ͭ���õĽ�������Ҳ��ŵ磬�������õ�������Ϊ2NAʱ���������ٵ�������һ����64g����D����
��ѡ��C��
���� ���⿼���˰���٤���������йؼ��㣬�������չ�ʽ��ʹ�ú����ʵĽṹ�ǽ���ؼ���ע��������ʲ��ֵ��룬����ˮ������ʣ��ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����2HI��g��?H2��g��+I2��g������ƽ�����С���������ʹ��ϵ��ɫ���� | |
| B�� | �ϳɰ���Ӧ��Ϊ��߰��IJ��ʣ�������Ӧ��ȡ�����¶ȵĴ�ʩ | |
| C�� | ��ҵ��ȡ������Na��l��+KCl��l��?NaCl��l��+K��g��ѡȡ���˵��¶ȣ�ʹK�������ӷ�Ӧ������з������ | |
| D�� | �����ơ�ƴ�����ĭ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
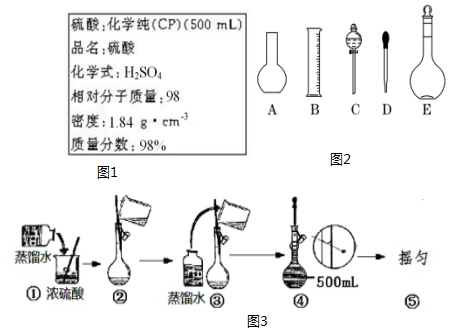
 ij��ѧС��Ϊ�Ƚ�����ʹ��������ǿ�������������ʵ�鷽����װ����ͼ���г������ԣ�
ij��ѧС��Ϊ�Ƚ�����ʹ��������ǿ�������������ʵ�鷽����װ����ͼ���г������ԣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������״̬�£�1molNa2O2 ��ȫ�������������ĿΪ 3NA | |
| B�� | �� CO2 ͨ�� Na2O2 ʹ������������ mg����Ӧ��ת�Ƶĵ����� m NA/14 | |
| C�� | �ڱ�״���£�22.4LCH4�� 18 gH2O �����еĵ�������Ϊ 10NA | |
| D�� | �� 1mol Cl-�� NH4Cl ��Һ�м���������ˮʹ��Һ�����ԣ���ʱ��Һ��NH4+����ĿΪNA�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ܵ�ʩ���У����ܽ���������ˮ����ͭ��ˮ��ͷ���� | |
| B�� | ��ѧ��Ӧ�����У�һ�������ʵı仯����һ���������ı仯 | |
| C�� | �����Ƶ�����������Һ�г�����һ���������ۺ����� | |
| D�� | ��֪C��ʯī��s���TC�����ʯ��s ����H��0����ʯī�Ƚ��ʯ�ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������� | B�� | ��ɢ������ֱ�� ��1-100nm֮�� | ||
| C�� | ��������������Ĥ | D�� | ���Ȼ�۳� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����2molNH3��Ӧ��ƽ��ʱ������92.4kJ������ | |
| B�� | ��ת��1.5mol���ӣ�������0.75mol��H2 | |
| C�� | ��V����N2��=3V����H2��ʱ����Ӧ�ﵽƽ�� | |
| D�� | ����Ӧ�ﵽƽ��ʱ������ѹǿ��V����С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2O2����ˮ | B�� | Ba��OH��2•8H2O��NH4Cl��s����ϲ����� | ||
| C�� | ���ȵ�̿��CO2��Ӧ | D�� | ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com