
 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$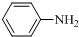 (苯胺,易被氧气氧化)
(苯胺,易被氧气氧化) .
. .写出③的转化关系
.写出③的转化关系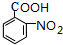 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (用已知中的表达方式表示,不用写化学方程式).
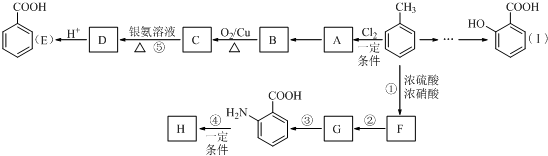
(用已知中的表达方式表示,不用写化学方程式). 分析  与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,故A为
与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,故A为 ,B为
,B为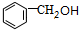 ,C为
,C为 ,D酸化生成E(
,D酸化生成E(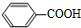 ),故D为
),故D为 .
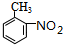
. 在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为
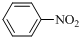
在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为 ,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为
,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为 ,H是一种功能高分子,链节组成为C7H5NO,与
,H是一种功能高分子,链节组成为C7H5NO,与 的分子式相比减少1分子H2O,为
的分子式相比减少1分子H2O,为 通过形成肽键发生缩聚反应生成的高聚物,H为
通过形成肽键发生缩聚反应生成的高聚物,H为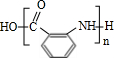 .
.
解答 解: 与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,故A为
与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,故A为 ,B为
,B为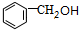 ,C为
,C为 ,D酸化生成E(
,D酸化生成E( ),故D为
),故D为 .
. 在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为
在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为 ,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为
,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为 ,H是一种功能高分子,链节组成为C7H5NO,与
,H是一种功能高分子,链节组成为C7H5NO,与 的分子式相比减少1分子H2O,为
的分子式相比减少1分子H2O,为 通过形成肽键发生缩聚反应生成的高聚物,H为
通过形成肽键发生缩聚反应生成的高聚物,H为 .
.
(1)B为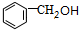 ,分子中官能团是羟基,H分子为功能高分子,其链节组成为C7H5NO,反应④是
,分子中官能团是羟基,H分子为功能高分子,其链节组成为C7H5NO,反应④是 发生缩聚反应生成高聚物,
发生缩聚反应生成高聚物,
故答案为:羟基;缩聚反应;
(2)反应⑤是 与银氨溶液发生氧化反应生成
与银氨溶液发生氧化反应生成 ,反应方程式为:
,反应方程式为: ,
,
故答案为: ;
;
(3)A.含有苯基,能与氢气发生加成反应,故A正确;
B.含有羧基、羟基,能与金属 Na发生反应,故B正确;
C.E中只含有羧基,化合物1含有羧基、羟基,含有官能团不完全相同,分子式不同,二者不是同分异构体,故C错误;
D.存在属于酯类的同分异构体,故D正确,
故答案为:C;
(4)F分子的结构简式: ,反应③的转化关系:
,反应③的转化关系: $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ ,
,
故答案为: ;
; $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ .
.
点评 不同考查有机物的推断与合成,根据反应条件及反应信息利用正推法与逆推法相结合进行判断,是对有机物知识的综合考查,能较好的考查学生的阅读、分析与思维能力,是有机热点题型.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:多选题
| A. | 溶液中c(OH-)减小 | B. | pH的变化值小于2 | ||
| C. | 溶液中H+的数目增大 | D. | Kw的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 推测 | |
| A | Mg与水反应缓慢,Ca与水反应较快 | Be与水反应会更快 |
| B | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| C | SiH4,PH3在空气中能自燃 | H2S在空气中也能自燃 |
| D | 标况下HCl,HBr均为气体 | HF也为气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂在NaOH热溶液中完全水解后,加入热饱和食盐水可观察到液面上有固体析出 | |
| B. | 容量瓶、滴定管和分液漏斗均标有“O”刻度线,使用前均需要检漏 | |
| C. | 实验室用二氧化锰与浓盐酸制氯气时,先加热二氧化锰再滴加浓盐酸 | |
| D. | 为检验摩尔盐中的NH4+,可向试样加入少量的稀Na0H,再用pH试纸检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇使酸性KMnO4溶液褪色,是因为发生了氧化反应 | |
| B. | 将苯加入溴水中,振荡后水层接近无色,是因为发生了取代反应 | |
| C. | 乙烯使溴的四氯化碳溶液褪色,是因为发生了加成反应 | |
| D. | 甲烷与氯气混合,光照一段时间后黄绿色消失,是因为发生了取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,该反应类型是加聚反应.
,该反应类型是加聚反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
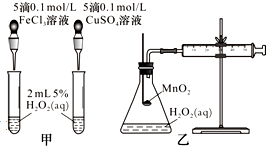 影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究.| 序号 | 温度/℃ | 催化剂 | 现象 | 结论 |
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com