
| A. | 取代反应 | B. | 氧化反应 | C. | 加成反应 | D. | 酯化反应 |
科目:高中化学 来源: 题型:选择题
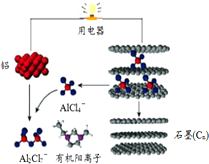 斯坦福大学华人化学家戴宏杰率领的团队研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
斯坦福大学华人化学家戴宏杰率领的团队研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 充电时,该电池负极应连接外接电源的负极 | |
| B. | 放电时,电子从铝流出经过电解质溶液到达石墨电极 | |
| C. | 充电时的阳极反应为:Cn+AlCl4--e-═CnAlCl4 | |
| D. | 放电时的负极反应为:Al-3e-+7AlCl4-═4Al2Cl7- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可用于自来水的杀菌消毒 | B. | 氧化铁可用于红色油漆和涂料 | ||
| C. | 油脂可用于在碱性溶液制取肥皂 | D. | 含氮、磷的污水可用于给土壤施肥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2S | B. | SO2 | C. | H2S | D. | SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属导电,属于电解质 | |
| B. | 乙酸是有机物,属于非电解质 | |
| C. | 只有在水溶液中能够导电的物质才属于电解质 | |
| D. | NaCl和Al2O3在熔融状态下均导电,都属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰主要成分是碱性化合物 | B. | 该过程只发生了物理变化 | ||
| C. | 生石灰主要成分是酸性化合物 | D. | 该过程同时实现了水软化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
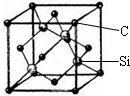 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com