

·ÖĪö £Ø1£©ŅŃÖŖ¢Ł2N2£Øg£©+6H2O£Øl£©?4NH3£Øg£©+3O2£Øg£©”÷H=+1530.0kJ/mol£®
¢ŚN2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷H=-93.0kJ/mol£¬ĄūÓĆøĒĖ¹¶ØĀɽ«$\frac{¢Ś”Į2-¢Ł}{6}$æɵĆĒāĘųČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½£»
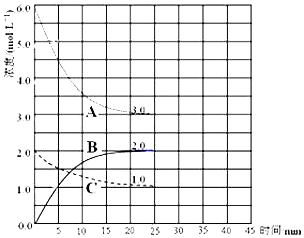
£Ø2£©¢Łøł¾ŻĶ¼ĻóæÉÖŖ£¬·“Ó¦½ųŠŠµ½25minŹ±ĒśĻßA¼õÉŁĮĖ6mol/L-3mol/L=3mol/L£¬C¼õÉŁĮĖ2.0mol/L-1.0mol/L=1.0mol/L£¬Ņņ“Ėøł¾Ż·½³ĢŹ½æÉÖŖ±ķŹ¾N2ÅØ¶Č±ä»ÆµÄĒśĻߏĒC£¬H2ÅØ¶Č±ä»ÆµÄĒśĻßĪŖA£¬BĪŖ°±ĘųµÄÅØ¶Č±ä»ÆĒśĻߣ»
¢ŚÓÉĶ¼æÉÖŖ£¬Ę½ŗāŹ±”÷c£ØA£©=3mol/L”¢”÷c£ØB£©=2mol/L”¢”÷c£ØC£©=1mol/L£¬¹Ź”÷c£ØA£©£ŗ”÷c£ØB£©£ŗ”÷c£ØC£©=3£ŗ2£ŗ1£¬¹ŹA“ś±ķĒāĘų”¢B“ś±ķ°±Ęų”¢C“ś±ķµŖĘų£¬øł¾Żv=$\frac{”÷c}{”÷t}$¼ĘĖćv£ØH2£©£»
¢ŪĢįøßN2µÄ×Ŗ»ÆĀŹ£¬Ó¦Ź¹Ę½ŗāÕżĻņŅĘ¶Æ£¬æÉŌö“óŃ¹Ē攢Ōö“óĒāĘųµÄÅØ¶ČµČ£»
£Ø3£©a£®Õż·“Ó¦ŹĒĢå»ż¼õÉŁµÄæÉÄę·“Ó¦£¬Ņņ“ĖŌŚŗćĪĀŗćŃ¹ĻĀĘųĢåĢå»ż²»ŌŁ±ä»ÆŹ±ŅŃĘ½ŗā£»
b£®ŌŚ·“Ó¦¹ż³ĢÖŠÖŹĮæŹ¼ÖÕ²»±ä£¬µ«ČŻĘ÷ČŻ»żŹĒ±ä»ÆµÄ£¬ĖłŅŌĆܶȏĒ±ä»ÆµÄ£¬Ņņ“ĖĘųĢåĆÜ¶Č²»ŌŁ±ä»ÆĖµĆ÷·“Ó¦“ļµ½Ę½ŗā£»
c£®Ę½ŗāŗó£¬Ķł×°ÖĆÖŠĶØČėŅ»¶ØĮæAr£¬Ń¹Ēæ²»±ä£¬ČŻĘ÷ČŻ»żŌö¼Ó£¬ÅØ¶Č½µµĶ£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£»
d£®Ę½ŗāŗó£¬Ń¹ĖõČŻĘ÷£¬Ń¹ĒæŌö“ó£¬Ę½ŗāĻņÕż·“Ó¦·½Ļņ½ųŠŠ£»
£Ø4£©øł¾ŻĶ¼2ÖŠĖę×ÅĪĀ¶ČÉżøߣ¬µŖĘų”¢N2OµÄŗ¬Įæ±ä»Æ½ųŠŠ·ÖĪö£»øł¾ŻĪĀ¶Č¶Ō»ÆŃ§Ę½ŗāÓ°Ļģ¼°Į½øöæÉÄę·“Ó¦µÄ·“Ó¦ČČĒéæö½ųŠŠ·ÖĪö£®
½ā“š ½ā£ŗ£Ø1£©ŅŃÖŖ¢Ł2N2£Øg£©+6H2O£Øl£©?4NH3£Øg£©+3O2£Øg£©”÷H=+1530.0kJ/mol£®
¢ŚN2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷H=-93.0kJ/mol£¬ĄūÓĆøĒĖ¹¶ØĀɽ«$\frac{¢Ś”Į2-¢Ł}{6}$æɵĆH2£Øg£©+$\frac{1}{2}$O2£Øg£©=H2O£Øl£©”÷H=-286.0 kJ/mol£¬
¹Ź“š°øĪŖ£ŗH2£Øg£©+$\frac{1}{2}$O2£Øg£©=H2O£Øl£©”÷H=-286.0 kJ/mol£»
£Ø2£©¢Łøł¾ŻĶ¼ĻóæÉÖŖ£¬·“Ó¦½ųŠŠµ½25minŹ±ĒśĻßA¼õÉŁĮĖ6mol/L-3mol/L=3mol/L£¬C¼õÉŁĮĖ2.0mol/L-1.0mol/L=1.0mol/L£¬Ņņ“Ėøł¾Ż·½³ĢŹ½æÉÖŖ±ķŹ¾N2ÅØ¶Č±ä»ÆµÄĒśĻߏĒC£¬AÅØ¶Č±ä»ÆµÄĒśĻßĪŖH2£¬BĪŖ°±ĘųµÄÅØ¶Č±ä»ÆĒśĻߣ¬
¹Ź“š°øĪŖ£ŗC£»
¢ŚÓÉĶ¼æÉÖŖ£¬Ę½ŗāŹ±”÷c£ØA£©=3mol/L”¢”÷c£ØB£©=2mol/L”¢”÷c£ØC£©=1mol/L£¬¹Ź”÷c£ØA£©£ŗ”÷c£ØB£©£ŗ”÷c£ØC£©=3£ŗ2£ŗ1£¬¹ŹA“ś±ķĒāĘų”¢B“ś±ķ°±Ęų”¢C“ś±ķµŖĘų£¬¹Źv£ØH2£©=$\frac{3mol/L}{25min}$=0.12 mol•L-1•min-1£¬¹Ź“š°øĪŖ£ŗ0.12mol/£ØL•min£©£»
¢Ūa£®ĶØČė1molN2£¬µŖĘų±¾Éķ×Ŗ»ÆĀŹ¼õŠ”£¬¹Ź“ķĪó£»
b£®ĶØČė1molH2£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬µŖĘųµÄ×Ŗ»ÆĀŹ±ä“󣬹ŹÕżČ·£»
c£®ĶØČė1molHeĘų£¬Ę½ŗā²»ŅĘ¶Æ£¬µŖĘųµÄ×Ŗ»ÆĀŹ²»±ä£¬¹Ź“ķĪó£»
d£®ĶØČė1molNH3£¬Ļąµ±ÓŚŌö“óŃ¹Ēæ£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬µŖĘųµÄ×Ŗ»ÆĀŹ±ä“󣬹ŹÕżČ·£»
e£®ĶØČė1molHCl£¬°±ĘųÅØ¶Č¼õŠ”£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬µŖĘųµÄ×Ŗ»ÆĀŹ±ä“󣬹ŹÕżČ·£»
f£®ĶØČė1molN2ŗĶ3molH2£¬Ļąµ±ÓŚŌö“óŃ¹Ēæ£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬µŖĘųµÄ×Ŗ»ÆĀŹ±ä“󣬹ŹÕżČ·£»
¹ŹŃ”£ŗbdef£»
£Ø3£©a£®·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ÉżøßĪĀ¶ČĘ½ŗāÄęĻņ½ųŠŠ£¬µŖĘų×Ŗ»ÆĀŹ¼õŠ”£¬¹Źa“ķĪó£»
b£®¼ÓČė“߻ƼĮøı䷓ӦĖŁĀŹ²»øıä»ÆŃ§Ę½ŗā£¬µŖĘų×Ŗ»ÆĀŹ²»±ä£¬¹Źb“ķĪó£»
c£®ĶØČė1molHeĘų×ÜŃ¹Ōö“󣬷ÖŃ¹²»±äĘ½ŗā²»±ä£¬µŖĘų×Ŗ»ÆĀŹ²»±ä£¬¹Źc“ķĪó£»
d£®ĶØČė1molHClŗĶ°±Ęų·“Ó¦£¬“Ł½ųĘ½ŗāÕżĻņ½ųŠŠ£¬µŖĘų×Ŗ»ÆĀŹŌö“󣬹ŹdÕżČ·£»
¹Ź“š°øĪŖ£ŗd£»
£Ø4£©øł¾ŻĶ¼ĻóæÉÖŖ£¬ŌŚ400K”«600KŹ±£¬Ę½ŗā»ģŗĻĘųÖŠN2ŗ¬ĮæĖęĪĀ¶ČµÄÉżøßÖš½„½µµĶ£»Ö÷·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ÉżøßĪĀ¶Č£¬Ę½ŗāĻņ×ÅÄęĻņŅĘ¶Æ£¬µŖĘųµÄŗ¬Įæ¼õŠ”£¬
¹Ź“š°øĪŖ£ŗĖęĪĀ¶ČÉżøߣ¬N2µÄŗ¬Įæ½µµĶ£»Ö÷·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ÉżĪĀŹ¹Ö÷·“Ó¦µÄĘ½ŗā×óŅĘ»ņÕßø±·“Ó¦ĪŖĪüČČ·“Ó¦£¬ÉżĪĀŹ¹ø±·“Ó¦µÄĘ½ŗāÓŅŅĘ£¬½µµĶĮĖNH3ŗĶNOÅØ¶Č£¬Ź¹Ö÷·“Ó¦µÄĘ½ŗā×óŅĘ£®
µćĘĄ ±¾Ģāæ¼²éøĒĖ¹¶ØĀÉ”¢»ÆŃ§Ę½ŗāĶ¼Ļ󔢻ÆŃ§Ę½ŗāŅĘ¶ÆµÄÓ°ĻģŅņĖŲ”¢Ōµē³ŲŌĄķµÄÓ¦ÓĆŗĶµē¼«·“Ó¦ŹéŠ“£¬ĢāÄæÄѶČÖŠµČ£¬×¢Ņā¶Ō»ł“”ÖŖŹ¶µÄĄķ½āÕĘĪÕ£®


 »ĘøŌ¾µäȤĪ¶æĪĢĆĻµĮŠ“š°ø
»ĘøŌ¾µäȤĪ¶æĪĢĆĻµĮŠ“š°ø Ęō¶«Š”Ģā×÷Ņµ±¾ĻµĮŠ“š°ø
Ęō¶«Š”Ģā×÷Ņµ±¾ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·²ŗ¬ÓŠĢķ¼Ó¼ĮµÄŹ³Īļ¶ŌČĖĢ彔浾łÓŠŗ¦£¬²»ŅĖŹ³ÓĆ | |
| B£® | ”°ö²³¾»ż¾ŪÄŃ¼ūĀ·ČĖ”±£¬Īķö²ĖłŠĪ³ÉµÄĘųČܽŗÓŠ¶”“ļ¶ūŠ§Ó¦ | |
| C£® | ČĖĢåȱ·¦ĢśŌŖĖŲ£¬æÉŅŌ²¹³äĮņĖįŃĒĢś£¬ĒŅ¶ą¶ąŅęÉĘ | |
| D£® | ”°ĒąŻļŅ»ĪÕ£¬ŅŌĖ®¶žÉż×Õ£¬½ŹČ”Ö”±£¬ĶĄßĻßĻ¶ŌĒąŻļĖŲµÄĢįČ”ŹōÓŚ»Æѧ±ä»Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.5 Ħ1£¬3-¶”¶žĻ©·Ö×ÓÖŠŗ¬ÓŠ¹²¼Ū¼üŹżĪŖ5.5N0 | |
| B£® | 1 mol¼×»ł£Ø-CH3£©Ėłŗ¬µÄµē×Ó×ÜŹżĪŖ9N0 | |
| C£® | 1 mol-OHŗĶ1 mol OH-Ėłŗ¬µē×ÓŹż¶¼ĪŖ9N0 | |
| D£® | 1 molĢ¼ÕżĄė×Ó£ØCH3+£©Ėłŗ¬µÄµē×Ó×ÜŹżĪŖ8N0 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | $\frac{1000Va}{MV+1120}$ mol•L -1 | B£® | $\frac{1000Va}{MV+22400}$ mol•L -1 | ||
| C£® | $\frac{1000Va}{MV+11200}$ mol•L -1 | D£® | $\frac{1000V•M}{2240£ØV+0.5£©a}$ mol•L -1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ż¢Ž¢ß | B£® | ¢Ł¢Ś¢Ü¢Ż | C£® | ¢Ł¢Ś¢Ž¢ß | D£® | ¢Ś¢Ū¢Ü¢Ż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ³£ĪĀĻĀ£¬4.2gŅŅĻ©ŗĶ±ūĻ©µÄ»ģŗĻĘųĢåÖŠŗ¬ÓŠµÄ·Ē¼«ŠŌ¼ü×ÜŹżĪŖ0.6NA | |
| B£® | µē½ā¾«Į¶ĶŹ±£¬µ±µēĀ·ÖŠ×ŖŅĘNAøöµē×Ó£¬Ńō¼«Čܽā32 gĶ | |
| C£® | ŌŚŗ¬ÓŠCH3COO-ĪŖ1.0 mol•L-1µÄ“×ĖįČÜŅŗÖŠ£¬H+ŹżÄæĀŌ“óÓŚNA | |
| D£® | V L a mol•L-1µÄĀČ»ÆĢśČÜŅŗÖŠ£¬ČōFe3+µÄŹżÄæĪŖ NA£¬ŌņCl-µÄŹżÄæ“óÓŚ3NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
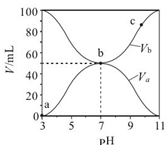
| A£® | Ka£ØHA£©=10-6 mol•L-1 | |
| B£® | b µćŹ±£¬c£ØB+£©=c£ØA-£©=c£ØH+£©=c£ØOH-£© | |
| C£® | c µćŹ±£¬$\frac{c£Ø{A}^{-}£©}{c£ØO{H}^{-}£©•c£ØHA£©}$ĖęĪĀ¶ČÉżø߶ų¼õŠ” | |
| D£® | a”śc ¹ż³ĢÖŠĖ®µÄµēĄė³Ģ¶ČŹ¼ÖÕŌö“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś¢Ü | B£® | ¢Ś¢Ū¢Ż | C£® | ¢Ś¢Ü¢Ż¢Ž | D£® | ¢Ū¢Ü¢Ž |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com