
【题目】氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化。
(1) 已知:2NO(g)+O2(g)===2NO2(g) ΔH1
NO(g)+O3(g)===NO2(g)+O2(g) ΔH2
2NO2(g)![]() N2O4(g) ΔH3
N2O4(g) ΔH3
2N2O5(g)===4NO2(g)+O2(g) ΔH4
则反应N2O4(g)+O3(g)===N2O5(g)+O2(g)的ΔH=__________。
(2)从N2O5在一定条件下发生分解:2N2O5(g)===4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/ (mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为p0,第2.00 min时体系压强为p,则p∶p0=________;1.00~3.00 min内,O2的平均反应速率为________。
(3)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。

①图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,列式计算该温度下反应的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②由图推测N2O4(g)![]() 2NO2(g)是吸热反应还是放热反应,说明理由_______________,若要提高N2O4转化率,除改变反应温度外,其他措施有____________(要求写出两条)。
2NO2(g)是吸热反应还是放热反应,说明理由_______________,若要提高N2O4转化率,除改变反应温度外,其他措施有____________(要求写出两条)。
【答案】-![]() ΔH1+ΔH2-ΔH3-
ΔH1+ΔH2-ΔH3-![]() ΔH41.750.090 mol·L-1·min-1115 kPa吸热反应温度升高,α(N2O4)增大,说明平衡右移 减小体系压强或移出NO2
ΔH41.750.090 mol·L-1·min-1115 kPa吸热反应温度升高,α(N2O4)增大,说明平衡右移 减小体系压强或移出NO2
【解析】
(1)①2NO(g)+O2(g)=2NO2(g) △H1,②NO(g)+O3(g)=NO2(g)+O2(g) △H2,③2NO2(g)N2O4(g) △H3,④2N2O5(g)=4NO2(g)+O2(g) △H4,根据盖斯定律②-![]() ①-③-
①-③- ![]() ④可得:N2O4(g)+O3(g)=N2O5(g)+O2(g),由此解答;
④可得:N2O4(g)+O3(g)=N2O5(g)+O2(g),由此解答;
(2)相同条件下,气体的物质的量之比等于其压强之比,根据三段式求出2.00min时体系该物质的浓度,然后先计算五氧化二氮的反应速率,再根据同一时间段内,各物质的反应速率之比等于其计量数之比计算氧气反应速率;
(3)①相同条件下,气体的物质的量之比等于压强之比,由此求出平衡时二氧化氮和四氧化二氮的浓度,进而求出其分压,然后带入化学平衡常数Kp=生成物分压幂之积除以反应物分压幂之积计算;
②升高温度,平衡向吸热方向移动;减小体系压强、移出NO2都能使平衡正向移动,据此分析解答。
(1)①2NO(g)+O2(g)=2NO2(g) △H1
②NO(g)+O3(g)=NO2(g)+O2(g) △H2
③2NO2(g)N2O4(g) △H3
④2N2O5(g)=4NO2(g)+O2(g) △H4
根据盖斯定律②-![]() ①-③-
①-③- ![]() ④可得:N2O4(g)+O3(g)=N2O5(g)+O2(g) △H=-
④可得:N2O4(g)+O3(g)=N2O5(g)+O2(g) △H=-![]() △H1+△H2-△H3-
△H1+△H2-△H3-![]() △H4;
△H4;
因此,本题正确答案是:-![]() ΔH1+ΔH2-ΔH3-
ΔH1+ΔH2-ΔH3-![]() ΔH4;
ΔH4;
(2)相同条件下,气体的物质的量之比等于其压强之比,列出三段式,有
2N2O5(g)![]() 4NO2(g)+O2(g)
4NO2(g)+O2(g)
开始时浓度(mol/L) 1 0 0
变化浓度(mol/L) 0.5 1 0.25
2 min时的浓度(mol/L) 0.5 1 0.25
反应前后气体的压强之比等于其物质的量之比,所以p:p0=(0.50+1.00+0.25)mol:1.00mol=1.75;
1.00~3.00 min内,N2O5的浓度变化量为0.36 mol/L,则O2浓度变化量为0.18 mol/L,平均反应速率为![]() =0.090 mol·L-1·min-1;
=0.090 mol·L-1·min-1;
因此,本题正确答案是:1.75; 0.090 mol·L-1·min-1 ;
![]() ×108kPa=151.2kPa,四氧化二氮的分压=151.2kPa×
×108kPa=151.2kPa,四氧化二氮的分压=151.2kPa×![]() =64.8kPa,二氧化氮的分压=151.2kPa×
=64.8kPa,二氧化氮的分压=151.2kPa×![]() =86.4kPa,化学平衡常数Kp=
=86.4kPa,化学平衡常数Kp=![]() =
=![]() =115kPa;
=115kPa;
②根据图知,升高温度转化率增大,平衡向吸热方向移动,则正反应是吸热反应;若要提高N2O4转化率,除改变反应温度外,其他措施有减小体系压强、移出NO2等。
因此,本题正确答案是:吸热反应;温度升高,α(N2O4)增大,说明平衡右移;减小体系压强或移出NO2。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】密闭容器中进行的反应为 X(g)+3Y(g) ![]() 2Z(g),X、Y、Z 的起始浓度依次为0.1 mol / L,0.3 mol / L,0.2 mol / L,当反应达平衡时,各物质的浓度可能是 ( )
2Z(g),X、Y、Z 的起始浓度依次为0.1 mol / L,0.3 mol / L,0.2 mol / L,当反应达平衡时,各物质的浓度可能是 ( )
A. X=0.2 mol / L,Y=0.6 mol / L B. Y=0.5 mol / L或Y=0.1 mol / L
C. Y=0.6 mol / L D. Z=0.4 mol / L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将体积为Va、pH=a的某一元酸HA溶液与体积为Vb、pH=b的某一元碱BOH溶液混合,请回答。
(1)若a + b=14,2Va=Vb,反应后所得溶液pH=7。则生成的盐溶液中,一定发生水解的离子方 程式为_______
(2)若a + b=12,酸是盐酸,碱是KOH,反应后所得溶液pH=7,则Va与Vb的关系是_______
(3)若酸是盐酸,碱是氨水,反应后所得溶液中离子浓度大小关系不可能是_________(填序号)
A.c(Cl-)>c(NH)>c(H+)>c(OH-) B.c(H+)>c(OH-)>c(Cl-)>c(NH)
C.c(NH)>c(Cl-)>c(OH-)>c(H+) D.c(Cl-)>c(H+)>c(NH)>c(OH-)
E.c(Cl-)=c(NH)>c(H+)=c(OH-)
(4)若酸是醋酸,碱是NaOH,且反应后混合溶液中c(CH3COO-)>c(H+),则混合溶液可能呈_____(填序号)
A.酸性 B.碱性 C.中性 D.都有可能
(5)25 ℃时,将体积Va=200 mL,pH=2的H2SO4溶液与体积Vb=10 mL、pH=11的氨水溶液混合,恰好完全反应。则此条件下,氨水的电离平衡常数是____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,浓度均为0.1 mol·L-1的4种钠盐溶液pH如下表,下列说法中正确的是( )
溶质 | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
pH | 11.6 | 10.3 | 8.3 | 5.2 |
A. 足量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO-===HClO+HSO
B. 向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
C. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3
D. NaHSO3溶液中离子浓度大小顺序为:c(Na+)>c(H+)>c(HSO)>c(SO![]() )>c(OH-)
)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的盐酸,丙为未知浓度的FeCl2溶液,试回答下列问题:
(1)甲溶液的pH=________。
(2)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为________。
(3)某化学兴趣小组认为在隔绝空气的环境中,用酸性KMnO4溶液能测定丙溶液的浓度(已知:5Fe2++MnO+8H+===5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需________(填写仪器名称)。
②滴定实验要用到酸式滴定管或碱式滴定管,使用该仪器的第一步操作是_______。
③某同学设计的下列滴定方式中,最合理的是________(夹持部分略去,填字母序号),达到滴定终点的现象是__________________________。
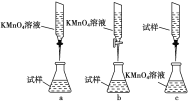
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-。NaHA溶液显酸性,则溶液中离子浓度的大小顺序为__________________________。
H++A2-。NaHA溶液显酸性,则溶液中离子浓度的大小顺序为__________________________。
(2)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq)滴加少量Na2A固体,c(Ca2+)___(填“增大”“减小”或“不变”),原因是______。
Ca2+(aq)+A2-(aq)滴加少量Na2A固体,c(Ca2+)___(填“增大”“减小”或“不变”),原因是______。
(3)含有![]() 的废水毒性较大,某工厂废水中含4.00×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含4.00×10-3 mol·L-1的Cr2O![]() 。为使废水能达标排放,作如下处理:
。为使废水能达标排放,作如下处理:![]()
![]() Cr2+、Fe3+
Cr2+、Fe3+![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
①该废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为:_______。
②若处理后的废水中残留的c(Fe3+)=1×10-13 mol·L-1,则残留的Cr3+的浓度为__________________。{已知:Ksp[Fe(OH)3]≈1.0×10-38 ,Ksp[Cr(OH)3]≈1.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程因发生取代反应而产生的是( )
A.乙烯使溴的四氯化碳溶液退色
B.将苯加入溴水中,振荡后水层接近无色
C.将苯、浓硫酸、浓硝酸混合后在55~60 ℃ 水浴中加热
D.液态植物油与氢气反应生成固态物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《汉书》中“高奴县有洧水可燃”,沈括在《梦溪笔谈》对“洧水”的使用有“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也,此物必大行于世”的描述,对上文进行的某些分析中正确的是
A. “洧水”的主要成分是油脂
B. “洧水”的主要成分是煤油
C. 烟的主要成分是炭黑
D. 烟的主要成分是石墨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。I可以用E和H在一定条件下合成:

已知以下信息:
A的核磁共振氢谱表明其只有一种化学环境的氢;R—CH=CH2![]() R—CH2CH2OH
R—CH2CH2OH
化合物F苯环上的一氯代物只有两种;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
请回答下列问题:
(1)C的化学名称为________________________。
(2)E的结构简式为______________________。
(3)A→B的反应类型为_________________、__________________;E+H→I的反应类型为_______________________。
(4)F生成G的化学方程式为____________________________________。
(5)E+H→I的化学方程式为___________________。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基;②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,这样的同分异构体共有_______种(不考虑立体异构)。J的一种同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com