
| A. | 0.57 mol | B. | 2.25mol | C. | 2 mol | D. | 0.63mol |
分析 根据m=ρV计算溶液的质量,结合镁离子质量分数计算m(Mg2+),再根据n=$\frac{m}{M}$计算n(Mg2+),溶液中n(Cl-)=2n(Mg2+),据此计算解答.
解答 解:300mL 该溶液的质量为:300mL×1.8g/mL=540g,
则m(Mg2+)=540g×5%=27g,其物质的量为:n(Mg2+)=$\frac{27g}{24g/mol}$=$\frac{9}{8}$mol,
溶液中n(Cl-)=2n(Mg2+)=$\frac{9}{8}$mol×2=2.25mol,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量与物质的量浓度、摩尔质量之间的关系即可解答,试题培养了学生的分析能力及化学计算能力.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 13:8:27 | B. | 13:9:27 | C. | 26:16:27 | D. | 286:8:27 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4 | |
| B. | 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数 | |
| C. | 液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质 | |
| D. | 溶液中c(H+)越大,pH也越大,溶液的酸性就越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(KJ•mol-1) | 436 | 343 | x | 465 | 413 |
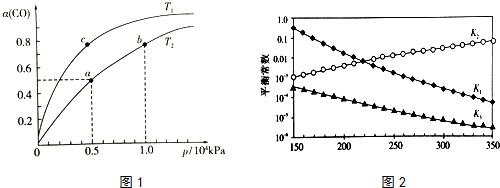
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
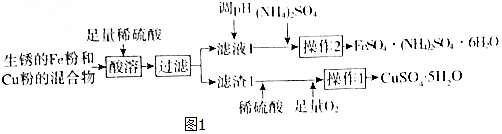
| FeSO4•7H2O | (NH4)2SO4 | FeSO4•(NH4)2SO4•6H2O | |
| 20℃ | 48 | 75 | 37 |
| 60℃ | 101 | 88 | 38 |
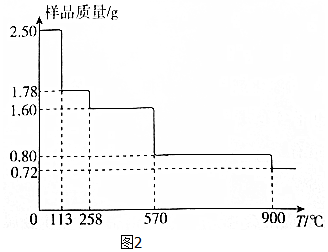
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验内容 | 实验目的 | |
| A | 向某未知溶液中加人BaCl2溶液后,再加人稀硝酸观察沉淀的生成 | 检验是否含 SO42-离子 |
| B | 向某未知溶液中加人NaOH固体,加热,在管口用湿润的蓝色石蕊试纸检验 | 检验是否含NH4+离子 |
| C | 加热分别用SO2和HClO漂白后的品红溶液 | 探究SO2和HCIO漂白原理的不同 |
| D | 加热盛有浓硫酸和铜的试管 | 探究浓硫酸的脱水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、Cl-、NO3- | B. | K+、NO3-、OH-、HCO3- | ||
| C. | Na+、Ca2+、Cl-、HCO3- | D. | SO42-、NH4+、S2-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com