
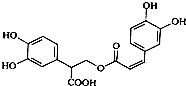
| A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸最多能和含6mol H2发生加成反应 | |
| C. | 迷迭香酸可以发生水解反应、消去反应和酯化反应 | |
| D. | 1mol迷迭香酸最多能和含6mol NaOH的水溶液完全反应 |
分析 由有机物的结构可知,含酚-OH、-COOH、-COOC-、C=C,结合酚、烯烃、酯、羧酸的性质来解答.
解答 解:A.芳香烃中只含C、H元素,则迷迭香酸不属于芳香烃,故A错误;
B.含苯环、C=C,1mol迷迭香酸最多能和7mol氢气发生加成反应,故B错误;
C.含-COOC-,能水解,含-OH、-COOH,则发生取代、酯化反应,但不能发生消去反应,故C错误;
D.1mol迷迭香酸含有4mol酚羟基、1mol羧基、1mol酯基,4mol酚羟基需要4mol氢氧化钠与其反应,1mol羧基需要1mol氢氧化钠与其反应,1mol酯基需要1mol氢氧化钠与其反应,所以1mol迷迭香酸最多能和含6molNaOH的水溶液完全反应,故D正确.
故选D.
点评 本题考查有机物的结构与性质,注意把握有机物的官能团极及其性质的关系来解答,熟悉酚、烯烃、羧酸、酯的性质是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | SO2为0.4 mol•L-1、O2为0.2 mol•L-1 | |
| B. | SO2为0.25 mol•L-1 | |
| C. | SO2、SO3均为0.15 mol•L-1 | |
| D. | SO3为0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铁溶液(硫酸亚铁):通入足量氯气,充分反应后加热,使多余氯气逸出 | |
| B. | 苯(苯酚):加入足量的浓溴水,充分振荡,静置分层后分离 | |
| C. | CO2(SO2):通入盛有Na2CO3溶液的洗气瓶 | |
| D. | Mg(OH)2:放入水中调成浆状,加入足量MgCl2溶液,充分搅拌,过滤,沉淀用蒸馏水洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,2.24L Cl2完全溶于水转移电子数为0.1NA | |
| B. | 1L 0.1mol•L-1 NaClO溶液中,ClO-的数目为NA | |
| C. | 2gNO2和44gN2O4的混合气体所含原子数为3NA | |
| D. | 18gD2O所含的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol/L NaCl溶液中含有Na+个数为2NA | |
| B. | 常温常压下,80g NH4NO3中含有氮原子数是NA | |
| C. | 18gNH4+中含有的电子数为10NA | |
| D. | 5.6g铁与稀硝酸反应转移的电子数目一定为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com