
【题目】科学家积极探索新技术对CO2进行综合利用。
I. CO2可用来合成低碳烯烃。
2CO2(g) +6H2(g)![]() CH2 =CH2(g) +4H2O(g) ΔH= a kJ/mol
CH2 =CH2(g) +4H2O(g) ΔH= a kJ/mol
请回答:
(1)已知:H2和CH2 =CH2的燃烧热分别是285.8kJ/mol和1411.0kJ/mol,且H2O(g)![]() H2O(1) ΔH = -44.0kJ/mol,则 a=____________kJ/mol。
H2O(1) ΔH = -44.0kJ/mol,则 a=____________kJ/mol。
(2)上述由CO2合成CH2 =CH2的反应在__________下自发进行(填“高温”或“低温”),理由是___________________。
(3)在体积为1L的密闭容器中,充入3mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。下列说法正确的是_________。
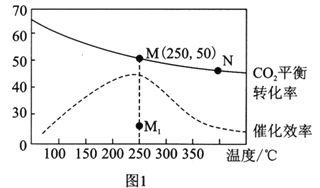
A.平衡常数大小:KM>KN
B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
C.图1中M点时,乙烯的体积分数为7.7%
D.当压强或n( H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
(4)保持温度不变,在体积为VL的恒容容器中以n(H2)∶n(CO2) = 3∶1的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2V L并保持不变,t2时重新达平衡。请在图2中作出容器内混合气体的平均相对分子质量![]() 随时间变化的图象_________。
随时间变化的图象_________。
II .利用“ Na—CO2”电池将CO2变废为宝。
我国科研人员研制出的可充电“ Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
(5)放电时,正极的电极反应式为______________________。
(6)若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol e-时,两极的质量差为_________g。
(7)选用髙氯酸钠—四甘醇二甲醚做电解液的优点是___________________________(至少写两点)。
【答案】-127.8 低温 根据△G=△H-T△S,△H<0 △S<0,要使反应自发进行使△G<0,需低温下进行。 AC 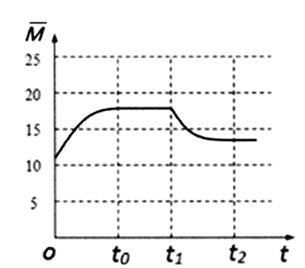
作图要求:O点坐标(0,12.5),t0平衡时![]() 在12.5到20之间,t1时体积瞬间扩大至2VL
在12.5到20之间,t1时体积瞬间扩大至2VL
时,平衡左移![]() 减小,但达到新平衡
减小,但达到新平衡![]() 大于12.5。 3CO2+4Na++4e-=2Na2CO3+C 15.8 导电性好、与金属钠不反应、难挥发等特点(合理给分)
大于12.5。 3CO2+4Na++4e-=2Na2CO3+C 15.8 导电性好、与金属钠不反应、难挥发等特点(合理给分)
【解析】
(1)已知H2(g)、C2H4(g)的燃烧热分别是-285.8kJ/mol、-1411.0kJ/mol,则有:①H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJ/mol;②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol;③H2O(g)
O2(g)=H2O(l)△H=-285.8kJ/mol;②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol;③H2O(g)![]() H2O(1) ΔH = -44.0 kJ/mol,根据盖斯定律 ①×6-②-③×4可得:2CO2(g) +6H2(g)
H2O(1) ΔH = -44.0 kJ/mol,根据盖斯定律 ①×6-②-③×4可得:2CO2(g) +6H2(g)![]() CH2 =CH2(g) +4H2O(g)△H=(-285.8kJ/mol)×6-(-1411.0kJ/mol)-(-44.0 kJ/mol)×4=-127.8kJ/mol;
CH2 =CH2(g) +4H2O(g)△H=(-285.8kJ/mol)×6-(-1411.0kJ/mol)-(-44.0 kJ/mol)×4=-127.8kJ/mol;
(2)2CO2(g) +6H2(g)![]() CH2 =CH2(g) +4H2O(g)△H=-127.8 kJ/mol,反应的△H<0,△S<0,根据△G=△H-T△S,需要△G<0,即低温下反应才能自发进行,故答案为:低温;根据△G=△H-T△S,△H<0 ,△S<0,要使反应自发进行使△G<0,需低温下进行;
CH2 =CH2(g) +4H2O(g)△H=-127.8 kJ/mol,反应的△H<0,△S<0,根据△G=△H-T△S,需要△G<0,即低温下反应才能自发进行,故答案为:低温;根据△G=△H-T△S,△H<0 ,△S<0,要使反应自发进行使△G<0,需低温下进行;
(3)A、升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M化学平衡常数大于N,故A正确;
B.使用催化剂,平衡不移动,温度不变,平衡时CO2的平衡转化率不变,故B错误;
C、设开始投料n(H2)为3mol,则n(CO2)为1mol,所以当在M点平衡时二氧化碳的转化率为50%,
所以有 6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)
CH2=CH2(g)+4H2O(g)
开始(mol/L) 3 1 0 0
转化 1.5 0.5 0.25 1
平衡 1.5 0.5 0.25 1
所以乙烯的体积分数为![]() ×100%=7.7%
×100%=7.7%
D.该反应属于气体的物质的量发生变化的反应,当压强不变时表示已经达到平衡状态,反应中 n( H2)/n(CO2)始终不变,不能证明化学反应已达到平衡状态,故D错误;
故选AC;
(4)反应前混合气体的平均相对分子质量=![]() =12.5,所以起点坐标为(0,12.5),随着反应进行,气体的物质的量减小,混合气体的平均相对分子质量增大,至t0时达到化学平衡,若全部转化为CH2=CH2和H2O平均相对分子质量=
=12.5,所以起点坐标为(0,12.5),随着反应进行,气体的物质的量减小,混合气体的平均相对分子质量增大,至t0时达到化学平衡,若全部转化为CH2=CH2和H2O平均相对分子质量=![]() =20,则t0达平衡时
=20,则t0达平衡时![]() 应在区间(12.5,20),t1时将容器体积瞬间扩大至2V L,平衡向逆方向移动,t2时重新达平衡,平均相对分子质量减小,t2达平衡时
应在区间(12.5,20),t1时将容器体积瞬间扩大至2V L,平衡向逆方向移动,t2时重新达平衡,平均相对分子质量减小,t2达平衡时 ![]() 应大于12.5,所以图象为
应大于12.5,所以图象为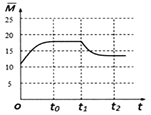 ,故答案为:
,故答案为: ;
;
(5)“吸入”CO2时是原电池装置,正极发生还原反应,电极反应式为:4Na++3CO2+4e-═2Na2CO3+C;
(6)若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,负极溶解0.1mol钠,质量为4.6g,正极生成0.1mol碳酸钠和0.05mol碳,质量为10.6g+0.6g=11.2g,两极的质量差为4.6g +11.2g=15.8 g;
(7)髙氯酸钠—四甘醇二甲醚做电解液的优点有导电性好、与金属钠不反应、难挥发等特点,故答案为:导电性好、与金属钠不反应、难挥发等特点。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是( )

选项 | 假设 | 结论 |
A | 甲为Al(OH)3 | 丁可能是盐酸 |
B | 甲为Na2CO3溶液 | 戊可能是CO2 |
C | 甲为Fe | 丁可能是盐酸 |
D | 甲为N2 | 戊可能是氧气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5 g HCl气体溶解在1 L水中(水的密度为1 g·cm-3),所得溶液的密度为ρ g·cm-3,质量分数为w,物质的量浓度为c,NA表示阿伏加德罗常数的数值,下列叙述中正确的是
A.所得溶液的物质的量浓度:c=1 mol·L-1B.所得溶液中含有NA个HCl分子
C.36.5 g HCl气体占有体积为22.4 LD.所得溶液的溶质质量分数:w=![]() ×100%
×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3 (g) △H<0,在某一时间段中反应速率与反应过程的曲线关系如图,t1、t3、t4时刻外界条件有所改变。下列说法正确的是( )
2NH3 (g) △H<0,在某一时间段中反应速率与反应过程的曲线关系如图,t1、t3、t4时刻外界条件有所改变。下列说法正确的是( )

A. t5~t6时氨气的体积分数最大 B. t3时升高了温度
C. t1时加入催化剂 D. t4时减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1mol·L-1NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是
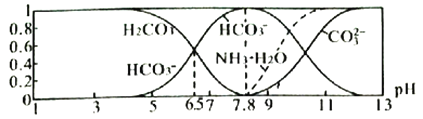
A. 当pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3·H2O)>c(CO32-)
B. NH4HCO3溶液中存在下列关系:![]() <1
<1
C. 向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小
D. 分析可知,常温下水解平衡常数Kh(HCO3-)的数量级为10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应aA(g)+bB(g) ![]() pC(g),已知:达到平衡后,升高温度,B的转化率变大;减小压强,C的质量分数减小。
pC(g),已知:达到平衡后,升高温度,B的转化率变大;减小压强,C的质量分数减小。
(1)该反应的逆反应是________反应(填“放热”或“吸热”),且a+b______p(填“<”、“>”或“=”)。
(2)温度、容器体积不变,平衡后加入B,A的转化率_________,B的转化率_________。(填“增大”、“减小”或“不变”)
(3)若升高温度,再次平衡时,B、C的浓度之比将_____________。(填“增大”、“减小”或“不变”)
(4)若加入催化剂,再次平衡时气体混合物的总物质的量___________。(填“增大”、“减小”或“不变”)
(5)若B是有色气体,A、C无色,平衡后压缩容器体积为原来的一半,再次平衡时,容器内气体颜色____。若维持容器内气体压强不变,充入Ne,再次平衡时,容器内气体颜色__________。(填“变深”、“变浅”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是
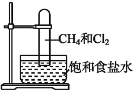
A. 此反应无光照也可发生
B. 甲烷和Cl2反应后的产物只有CH3Cl和HCl
C. 盛放饱和食盐水的水槽底部会有少量晶体析出
D. CH4和Cl2完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。
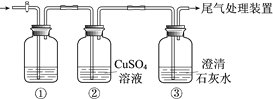
实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A. ③中白色浑浊是CaCO3
B. ②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C. 实验Ⅰ①中CO2过量发生的反应是:CO2+H2O+ S2== CO32+ H2S
D. 由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下图中氮元素及其化合物的转化关系,回答问题:
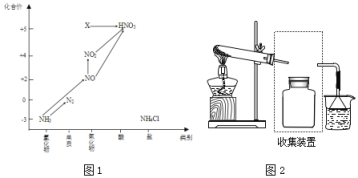
(1)图1中,X的化学式为___,从化合价上看,X具有___性(“氧化”、“还原”)。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为________。
②下列试剂不能用于干燥NH3的是___(填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③若要收集一瓶氨气,请将上述装置补充完整,在图2虚框内画出连接图___。
④氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式__________________________ 。
(3)回答下列关于NO、NO2的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:___________________
②NO和NO2按一定比例混合可以被NaOH溶液完全吸收,写出相关化学方程式_____________。
工业生产中利用氨水吸收SO2和NO2,原理如下图所示:
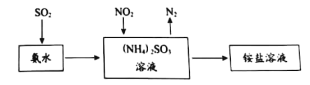
NO2被吸收过程的离子方程式是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com