
(14分)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
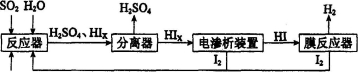
回答下列问题:
(1)在反应器中发生反应的化学方程式是______________。
(2)在膜反应器中发生反应:2HI(g)  H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示:
H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示:
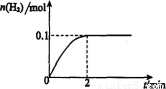
①该温度下,反应平衡常数K=_______,若升高温度,K值将_______
(填“增大”、“减小”或“不变?’)。
②用化学平衡原理解释使用膜反应器及时分离出H2的目的是___________________
(3)电渗析装置如下图所示:
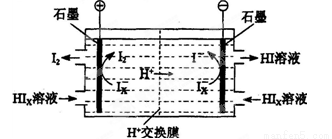
①结合电极反应式解释阴极区HIx转化为HI的原理是______________________________
②该装置中发生的总反应的化学方程式是________________________
(4)上述工艺流程中循环利用的物质是_________。
(1)SO2+xI2+2H2O=H2SO4+2HIx;(2)①1/64,增大;②及时分离出H2,使平衡正向移动,提高HI的分解率;(3)①在阴极区发生反应:Ix-+(x-1)e-=xI-,且阳极区的H+通过交换膜进入阴极区,得以生成HI溶液;② 2HIx (x-1)I2+2HI;(4) I2
(x-1)I2+2HI;(4) I2
【解析】
试题分析:(1)根据流程示意图可知:在反应器中发生反应的化学方程式是SO2+xI2+2H2O=H2SO4+2HIx;(2)①该温度下,反应平衡常数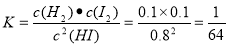 ;由于该反应的正反应是吸热反应,实验根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,实验化学平衡常数K值将增大;②使用膜反应器及时分离出H2,也就是减小了生成物的浓度,根据平衡移动原理,化学平衡向正反应方向移动,可以产生更多的生成物,从而提高了HI的分解率。(3)①由于阴极是与电源的负极连接的电极,有较多的负电荷,所以在阴极上发生反应:Ix-+(x-1)e-=xI-,根据同种电荷相互排斥,异种电荷相互吸引的原则,阳极区的H+通过交换膜进入阴极区,从而生成HI溶液;②根据电极反应式可知:该装置中发生的总反应的化学方程式是2HIx
;由于该反应的正反应是吸热反应,实验根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,实验化学平衡常数K值将增大;②使用膜反应器及时分离出H2,也就是减小了生成物的浓度,根据平衡移动原理,化学平衡向正反应方向移动,可以产生更多的生成物,从而提高了HI的分解率。(3)①由于阴极是与电源的负极连接的电极,有较多的负电荷,所以在阴极上发生反应:Ix-+(x-1)e-=xI-,根据同种电荷相互排斥,异种电荷相互吸引的原则,阳极区的H+通过交换膜进入阴极区,从而生成HI溶液;②根据电极反应式可知:该装置中发生的总反应的化学方程式是2HIx (x-1)I2+2HI;(4)在上述工艺流程中循环利用的物质是I2。
(x-1)I2+2HI;(4)在上述工艺流程中循环利用的物质是I2。
考点:考查化学方程式、电解方程式、电极式的书写、化学平衡常数的计算及温度对它的影响、浓度对化学平衡移动的影响的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014重庆市下学期期中考试高二化学试卷(解析版) 题型:选择题
下列化学实验事实及其结论都正确的是( )
选项 | 实验事实 | 结论 |
A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
C | 稀、浓硝酸分别与铜反应,还原产物分别为NO和NO2 | 稀硝酸氧化性比浓硝酸强 |
D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期期中考试高一化学试卷(解析版) 题型:选择题
下列顺序正确的是( )
A.熔点: SiO2 < NaF<KCl B.水溶性:NH3<SO2<HCl
C.酸性:HF>HCl>HI D.碱性:Mg(OH)2<KOH<RbOH
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市5月高三月考理综化学试卷(解析版) 题型:选择题
下列有关物质的性质或应用的说法不正确的是
A.石油的分馏主要是获得芳香烃
B.蛋白质溶液具有丁达尔效应,说明该蛋白质分子直径约1nm~100nm
C.肥皂是油脂在碱性条件下水解生成的
D.甲醛是合成树脂的常见原料之一
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市名校联盟高三三诊理综化学试卷(解析版) 题型:选择题
甲、乙、丙三种有机物的结构简式如下图所示,下列说法不正确的是
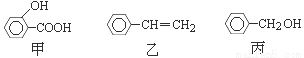
A.甲、乙、丙都能发生加成反应、取代反应
B.丙与C6H5OH都含有-OH,质谱图显示的质荷比最大值相差14,但不属于同系物
C.淀粉、油脂、有机玻璃等都属于高分子化合物
D.乙的化学名称为苯乙烯,能使溴水褪色,但不存在顺反异构体
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市高三5月月考理综化学试卷(解析版) 题型:选择题
下列说法正确的是:
A.常温下醋酸分子不可能存在于pH>7的碱性溶液中
B.在0.1mol/LNa2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32﹣)减小
C.0.1mol·L﹣1NH4C1溶液与0.05mol·L﹣1 NaOH溶液等体积混合溶液中离子浓度:
c(Cl﹣)>c(NH4+)>c(Na+)>c(OH﹣)
D.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN﹣),则a一定小于b
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市六校高三5月第三次诊断性考试理综化学试卷(解析版) 题型:填空题
(14分)药物菲那西汀的一种合成路线如下:

(1)菲那西汀的分子式
(2)反应①②④⑤中在苯环上发生取代反应的是
(3)反应②中生成的无机物是水和 (填化学式)
(4)写出反应⑤的化学方程式________________________________________________
(5)菲那西汀在硫酸催化下水解的化学方程式是_____________。
(6)菲那西汀的同分异构体中,符合下列条件的共有 种。
①含苯环且只有对位两个取代基 ②苯环上含有氨基 ③能水解,水解产物能发生银镜反应。
(7)菲那西汀的同分异构体中,含苯环且只有对位两个取代基,两个取代基含有相同碳原子数,且含有α-氨基酸结构,写出这种同分异构体缩聚后高分子产物的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市主城七区高三下学期第二次联考理综化学试卷(解析版) 题型:选择题
下述实验方案能达到实验目的的是
选项 | A | B | C | D |
实验 方案 |
食盐水 | 片刻后在Fe电极附近 滴入K3[Fe(CN)6]溶液 |
酸性KMnO4溶液 |
置于光亮处 |
实验 目的 | 验证铁钉发生了 析氢腐蚀 | 验证Fe电极被保护 | 验证乙烯的产生 | 验证甲烷与氯气发生了化学反应 |
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:填空题
(12 分)T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,在催化剂辅助下发生反应:N2(g)+3H2(g) 2NH3(g) △H=-92.0kJ /mol。t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如下图所示。
2NH3(g) △H=-92.0kJ /mol。t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如下图所示。
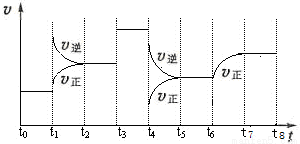
试回答下列问题:
(1)T℃时,N2的转化率为:___________,该反应的平衡常数K=___________。
(2)T℃时,下列能证明该反应已经建立平衡状态的是:__________________。
A.体系总压强不再改变
B.混合气体颜色不再改变
C.H2的质量百分含量不再改变
D.c(N2)与c(NH3)的比值不再改变
(3)t1时刻,改变的外界条件是__________,平衡常数K(t5~t6) ______ K(t7~t8)(填“>、<或=”,下同)。
(4)T℃时,建立平衡后,向容器中加入2molN2和2molNH3,则此时 v正 ___ v逆。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com