
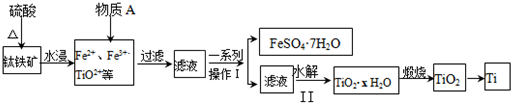
分析 钛铁矿[主要成分为钛酸亚铁(FeTiO)3,加硫酸溶解生成TiO2+和Fe3+、Fe2+等,加入A后制备FeSO4,则A为铁粉,用于还原Fe3+,过滤除去滤渣,将滤液蒸发浓缩、冷却结晶、过滤得到FeSO4•7H2O晶体和含有TiO2+的溶液,TiO2+经过水解得TiO2•xH2O,TiO2•xH2O再煅烧得TiO2,将TiO2还原可得Ti,以此解答该题.
解答 解:根据题中流程可知,钛铁矿[主要成分为钛酸亚铁(FeTiO)3,加硫酸溶解生成TiO2+和Fe3+、Fe2+等,再加铁粉还原Fe3+,过滤除去滤渣,将滤液蒸发浓缩、冷却结晶、过滤得到FeSO4•7H2O晶体和含有TiO2+的溶液,TiO2+经过水解得TiO2•xH2O,TiO2•xH2O再煅烧得TiO2,将TiO2还原可得Ti,
(1)钛铁矿与硫酸反应的主要反应的化学方程式为FeTiO3+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$TiOSO4+FeSO4+2H2O,
故答案为:FeTiO3+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$TiOSO4+FeSO4+2H2O;
(2)根据上面的分析可知,物质A为 Fe,用于还原铁离子,故答案为:Fe;
(3)步骤Ⅱ中TiO2+经过水解得TiO2•xH2O,发生反应的离子方程式为TiO2++(x+1)H2O═TiO2•xH2O↓+2H+,水解过程中需要升高温度,可加快反应水解速率,升温促进平衡正向移动,提高产率,
故答案为:TiO2++(x+1)H2O═TiO2•xH2O↓+2H+;升温促进平衡正向移动,提高产率;
(4)①电解TiO2获得Ti,用TiO2为阴极,其阴极的电极反应式为TiO2+4e-═Ti+2O2-,故答案为:TiO2+4e-═Ti+2O2-;
②将TiO2、氯气和过量焦炭混合,高温反应生成TiCl4,反应的方程式为TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO,根据方程式可知,反应中氯气为氧化剂,碳为还原剂,氧化剂与还原剂的物质的量之比为1:1,由于钛和镁在与空气在高温反应所以反应需在Ar气氛中,
故答案为:1:1;防止高温下Mg(或Ti)与空气中的O2(或CO2、N2)反应.
点评 本题考查物质制备,为高考常见题型,题目涉及流程分析判断,实验基本操作,离子方程式的书写,数据计算等,综合性较强,考查学生对所学知识的综合应用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 5:8 | B. | 5:4 | C. | 5:3 | D. | 3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率.
乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率.| 名称 | 式量 | 性状 | 密度/g/cm3 | 沸点/℃ | 溶解度 |
| 苯胺 | 93 | 无色油状液体,具有还原性 | 1.02 | 184.4 | 微溶于水,易溶于乙醇、乙醚等 |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水,易溶于乙醇、乙醚 |
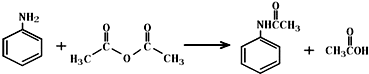
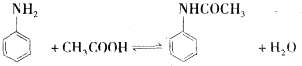 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
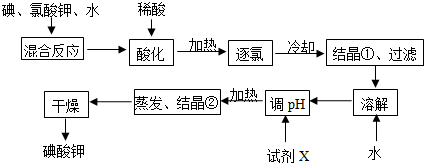
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
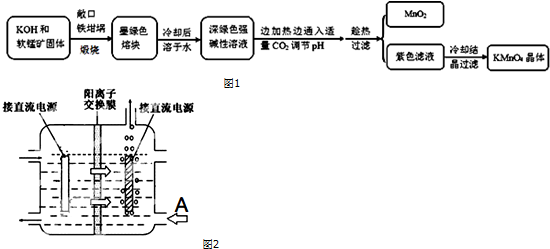
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉定时 | 8.3 | 7.6 | 2.7 | 6.7 |
| 完全沉淀时 | 9.8 | 9.6 | 3.7 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
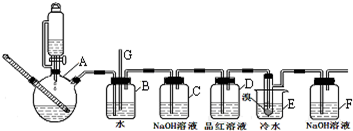
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在试管a中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL 乙酸,按图所示,连接好装置进行实验,以制取乙酸乙酯.回答下列问题:
在试管a中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL 乙酸,按图所示,连接好装置进行实验,以制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溶质用蒸馏水溶解后,未冷却即转移至容量瓶中并定容 | |
| B. | 未洗涤溶解溶质用的烧杯及玻璃棒 | |
| C. | 定容时仰视刻度线观察液面 | |
| D. | 容量瓶中原来含有少量蒸馏水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com